Tiocianato: formación, estructura, tipos, usos
El tiocianato es un anión inorgánico cuya fórmula es SCN–. Se trata de lo que se conoce por seudohalogenuro, pues su comportamiento químico se asemeja al de los halogenuros, es decir, al fluoruro, cloruro, etc. También se le conoce con el nombre de rodanida, aunque este actualmente es utilizado con menor frecuencia.
El tiocianato es una especie curiosa, porque se posiciona en la frontera entre la química orgánica y la inorgánica. Perfectamente forma parte tanto de compuestos orgánicos como inorgánicos, variando solamente el modo en que se enlaza o interacciona. Este seudohalogenuro tiene una fuerte vinculación bioquímica con los iones cianuros y su metabolismo.

En la imagen superior se tiene una representación del SCN– utilizando un modelo de espacio lleno. La esfera amarilla corresponde al átomo de azufre, mientras que la negra y la azulada son los átomos de carbono y nitrógeno, respectivamente. El tiocianato tiene un hermano oxigenado: el cianato, OCN–, en el que se sustituye el átomo de azufre por uno de oxígeno.
El tiocianato de potasio, KSCN, es uno de los ejemplos más representativos para este seudohalogenuro. Por otro lado, en química orgánica se tienen los tiocianatos cuyas fórmulas generales vienen a ser RSCN, tal como el tiocianato de metilo, CH3SCN.
Índice del artículo
La fórmula SCN– permite entrever de un solo vistazo que su síntesis se basa en la reacción del cianuro, CN–, con una especie que done los átomos de azufre. En efecto, el cianuro bien puede reaccionar con el azufre elemental, S8, o con los aniones tiosulfatos, S2O32- para producir el tiocianato:
8 CN− + S8 → 8 SCN−
CN− + S2O32- → SCN− + S2O32-
No obstante, la segunda reacción es catalizada por un sistema de enzimas compuestas de tiosulfato sulfurtransferasas. Nuestro organismo dispone de estas enzimas, y por lo tanto, somos capaces de metabolizar los cianuros que provienen de los cianoglucósidos (carbohidratos que tienen el grupo CN). De esta manera, el cuerpo se deshace de los nocivos CN–, los cuales interfieren en los procesos de la respiración celular.
Los tiocianatos se encuentran disueltos en la saliva y, en menor grado, en el plasma. Sus niveles de concentración revelan cuán expuestos están los individuos a los cianuros, ya sea por una excesiva ingesta de alimentos que lo contienen en su forma natural (nueces, almendras, legumbres, linazas, etc.), o por inhalación prolongada del humo de los cigarrillos y tabacos.
El SCN– puede obtenerse mediante la neutralización de su forma ácida: el ácido tiociánico, HSCN o isotiociánico, HNCS. Dependiendo de la base que se utilice, se obtendrá además una sal de tiocianato.
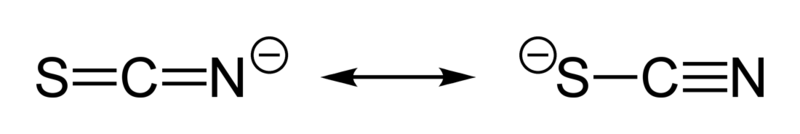
En la imagen superior se muestra cómo se distribuye la carga negativa del SCN–. Nótese que todos los átomos tienen hibridación sp2, por lo que se sitúan en una misma línea.
El par de electrones puede ubicarse bien sobre el átomo de nitrógeno, o sobre el átomo de azufre. Este hecho explica una característica importante del tiocianato: es un ligando bidentado, es decir, capaz de enlazarse de dos maneras diferentes.
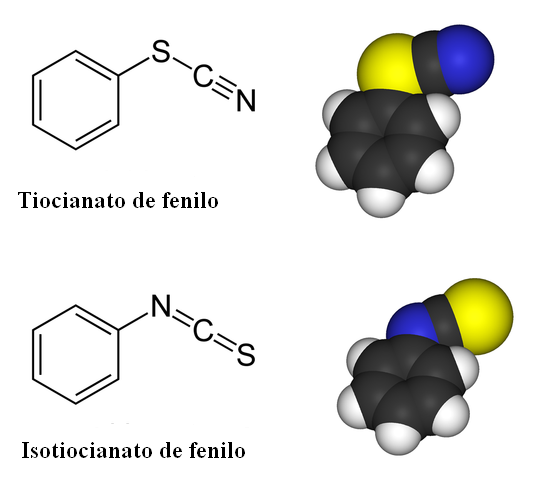
En los compuestos de tiocianato está presente la isomería de enlace. Como se aprecia en la imagen superior, el SCN– puede enlazarse a un anillo bencénico o grupo fenilo ya sea mediante su átomo de azufre o el átomo de nitrógeno. Cuando se enlaza con el S, recibe el nombre de tiocianato; mientras que cuando se enlaza con el N, recibe el nombre de isotiocianato.
Nótese cómo el –SCN o –NCS lucen como fragmentos lineales. Esta geometría lineal se mantiene inalterada tanto en los tiocianatos orgánicos como en los inorgánicos.
El enlace –NCS es más fuerte que el –SCN, debido a que el nitrógeno, por ser más pequeño, concentra mejor la carga negativa del par de electrones con que formará el enlace covalente.
Los aniones SCN– no pueden interaccionar entre sí a causa de las repulsiones electrostáticas. Por lo tanto, necesitan de cationes para que puedan interaccionar electrostáticamente, y así “edificar” un cristal. Los tiocianatos inorgánicos son compuestos en esencia iónicos.
Mientras, para los tiocianatos orgánicos sus interacciones se basan en las fuerzas de Van der Waals; especialmente, las de tipo dipolo-dipolo. El grupo SCN, sea como esté enlazado, es polar y por tanto contribuye a un incremento de la polaridad del compuesto. Evidentemente, las interacciones dipolo-dipolo son más débiles que las atracciones iónicas, presentes por ejemplo en el KSCN (K+SCN–).
Los tiocianatos orgánicos se representan con la fórmula RSCN. Por otra parte, habiendo isomería de enlace, también tenemos los isotiocianatos, RNCS.
Así, basta sustituir R por fragmentos moleculares alquílicos o aromáticos para obtener varios compuestos. Por ejemplo, el CH3CH2SCN es el tiocianato de etilo. En el apartado anterior se sustituyó R por un anillo bencénico, para obtener el tiocianato de fenilo, C6H5SCN o φ-SCN.
Los tiocianatos inorgánicos se consideran sales del ácido tiociánico, HSCN, y pueden representarse como MSCN, donde M es un catión metálico o el catión amonio. Así, tenemos por ejemplo:
-NaSCN, tiocianato de sodio
-NH4SCN, tiocianato de amonio
-Fe(SCN)3, tiocianato férrico
Muchos tiocianatos inorgánicos se tratan de sales sólidas incoloras.
Por otro lado, tenemos también los complejos de tiocianatos en solución. Por ejemplo, una solución acuosa que contiene iones Fe3+ se acomplejará con los iones SCN– para formar [Fe(NCS)(H2O)5]2+, el cual es de color rojo sangre.
Similarmente, el SCN– es capaz de acomplejarse con otros cationes metálicos, tales como Co2+, Cu2+ y Ti4+, cada uno originando un complejo colorido.
El anión SCN– se utiliza para determinaciones fotométricas de metales en soluciones acuosas. Este método se basa precisamente en la medición de las absorbancias de los complejos coloridos de tiocianatos con los metales.
Fuera de este uso específico, los demás son tan variados como los tiocianatos que existen.
Los tiocianatos orgánicos se destinan más que todo como bloques estructurales para la síntesis de compuestos sulfurados utilizados en medicina.
En cambio, los tiocianatos inorgánicos que presentan coloraciones se utilizan para la industria textil o como aditivos para las pinturas de embarcaciones. Asimismo, por ser buenos donadores de iones SCN–, se requieren para la producción de insecticidas y fungicidas.
De los tiocianatos, los más populares son el NaSCN y KSCN, ambos muy solicitados en las industrias de medicamentos, construcciones, electrónicas y agroquímicas.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Thiocyanate. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Thiocyanate. PubChem Database., CID=9322. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Thiocyanate. ScienceDirect. Recuperado de: sciencedirect.com
- Nouryon. (2020). Thiocyanate. Recuperado de: sulfurderivatives.nouryon.com
- Riedel, K., Hagedorn, H.W. and Scherer, G. (2013). Thiocyanate in plasma and saliva [Biomonitoring Methods, 2013]. In The MAK‐Collection for Occupational Health and Safety (eds and ). doi:10.1002/3527600418.bi5712sale0013
