Isopreno: estructura, propiedades, aplicaciones
El isopreno o 2-Metil-1,3-butadieno, es un compuesto orgánico que consiste de un hidrocarburo cuya fórmula molecular es C5H8. Pese a su aparente simpleza, representa la base estructural del caucho natural y, aún más importante, el esqueleto de las unidades biológicas con las que se sintetizan enzimáticamente los isoprenoides o terpenos.
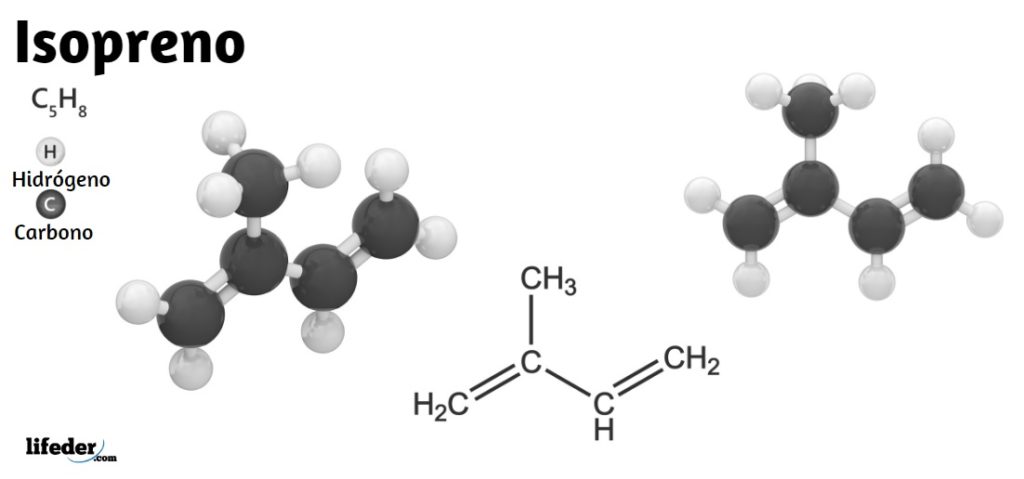
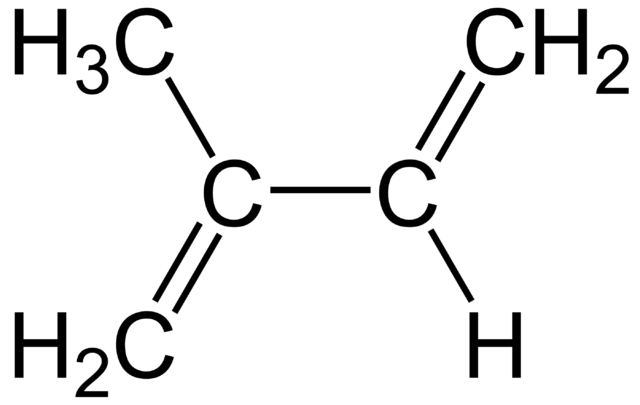
Por lo tanto, el isopreno guarda protagonismo no solo en la química orgánica sino también en la bioquímica. En la imagen inferior se aprecia su fórmula estructural, la cual puede desglosarse linealmente como CH2=C(CH3)−CH=CH2. A partir de esta fórmula se entiende por qué su nombre IUPAC es 2-Metil-1,3-butadieno, ya que los dos dobles enlaces se sitúan en los carbonos 1 y 3.
El isopreno es un hidrocarburo considerablemente común en el medio ambiente. Las plantas, las algas, las bacterias y los animales son capaces de sintetizarlo y emitirlo, conformando inclusive la parte más abundante de nuestras exhalaciones. Las masas vegetales son los principales productores y emisores de isopreno, utilizándolo en mecanismos para soportar el calor exterior.
Bioquímicamente, el isopreno en su unidad biológica es usado por los organismos para sintetizar varios tipos de terpenos, entre los cuales destacan el lanosterol y los componentes de los aceites esenciales. Orgánicamente, sirve para la síntesis de cauchos sintéticos y otros polímeros afines.
Índice del artículo
- 1 Estructura del isopreno
- 2 Propiedades del isopreno
- 3 Unidades biológicas
- 4 Aplicaciones del isopreno
- 5 Referencias
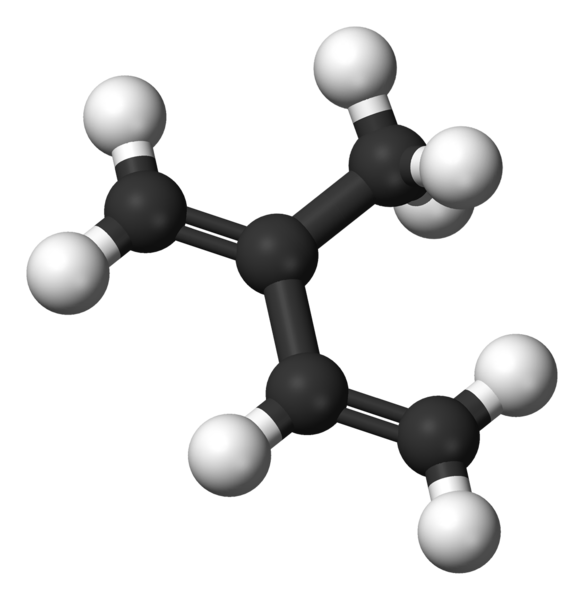
En la imagen superior tenemos la estructura molecular del isopreno. Tal como se aprecia, las esferas negras corresponden a los átomos de carbono, mientras las blancas son los átomos de hidrógeno.
La molécula presenta una geometría plana, es decir, todos sus átomos se disponen en un mismo plano, exceptuando los hidrógenos del grupo –CH3 enlazado al carbono 2. Esta geometría se debe a que los átomos de carbono del esqueleto 1,3-butadieno tienen hibridación sp2, mientras que el carbono del –CH3 tiene hibridación sp3.
Las moléculas de isopreno interaccionan entre sí mediante fuerzas dispersivas de London, las cuales son considerablemente débiles a causa de sus bajas masas moleculares. Sin embargo, ejercen la cohesión suficiente para que el isopreno exista como un líquido volátil en condiciones normales.
El hecho de que sus moléculas sean planas facilita su inserción entre las membranas celulares, contribuyendo a sus reforzamientos en el mecanismo que utilizan las plantas para amortiguar los cambios bruscos de temperatura (40 ºC o más).
Las moléculas de isopreno son capaces de formar cristales. Pero no sucede de igual modo con sus polímeros, los polisoprenos, los cuales tienden a agruparse en sólidos amorfos, cuyas masas moleculares promedio son mucho más grandes, dejando de ser una sustancia volátil.
Las propiedades aquí mencionadas corresponden a las del isopreno y no a las del caucho natural, el cual consiste del polímero cis-1,4-polisopreno. Algunas fuentes bibliográficas pueden utilizar inclusive las propiedades del látex recién extraído de los árboles para caracterizar al isopreno, siendo un error grave el confundirlas.
Líquido incoloro y volátil con un olor parecido al del petróleo.
68.12 g/mol
-143.95 ºC
34.067 ºC. Por lo tanto, es un líquido bastante volátil.
-54 ºC (copa cerrada)
395 ºC
0.681 g/cm3
2.35 en relación con el aire.
550 mmHg a 25 ºC, lo cual está en concordancia con su gran volatilidad.
Al ser un hidrocarburo es inmiscible con el agua, ubicándose en sus mezclas por encima de esta debido a que es menos denso. Sin embargo, es miscible con la acetona, el benceno, el éter de petróleo, el disulfuro de carbono, el diclorometano, y prácticamente con cualquier otro solvente aromático o clorado.
16.9 dinas/cm.
El isopreno puede reaccionar nucleofílicamente (atacado por especies ricas en electrones) a través de sus carbonos 1 y 4. Es así que por los extremos de su esqueleto carbonado puede polimerizarse, lo cual da lugar a polisoprenos. Esta reacción de polimerización es exotérmica, hasta tal punto que en contacto con algunas sustancias puede llegar a ser explosiva.
El isopreno, si bien está intrínsecamente presente en las estructuras de los terpenos, no es el material de partida que utilizan las enzimas para sintetizarlos. En su lugar, usan como sustratos productos metabólicos llamados pirofosfato de isopentenilo (IPP, azul) y pirofosfato de dimetilalilo (DMAPP, rojo).
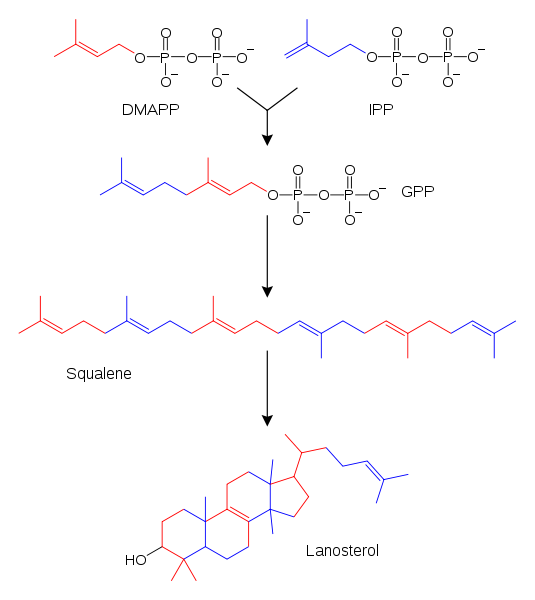
En la imagen superior se brinda un ejemplo de lo mencionado arriba. Ambos, tanto el IPP como el DMAPP, reaccionan entre sí gracias a la intervención enzimática para originar el pirofosfato de geranilo (GPP).
Este último, a su vez, va incorporando otros fragmentos moleculares provenientes del IPP o DMAPP (ver colores), hasta convertirse en el escualeno, un precursor valioso para la síntesis del lanosterol.
Entonces, el isopreno en su unidad biológica (IPP o DMAPP) participa en la biosíntesis de esteroles y otros lípidos. Asimismo, tenemos terpenos, tales como el limoneno (de los aceites de limón y naranjas) y el mirceno (del aceite del arrayán), que componen los aceites esenciales, y que se sintetizan mediante procesos química y estructuralmente similares.
En este sentido, la unidad de isopreno, a veces claramente reconocible en los terpenos o isoprenoides, es primordial para la síntesis de sinfines de productos naturales.

El isopreno se halla polimerizado en el caucho natural, por lo que todas sus aplicaciones pueden atribuírsele a este compuesto de un modo indirecto. Forma parte de la gutapercha, material elástico hecho con una mezcla de polímeros cis y trans 1,4-polisopreno, la cual una vez se utilizó para la fabricación de las pelotas de golf.
El caucho sirve para la elaboración de pelotas, mangueras, guantes, condones, botas, accesorios de instrumentos eléctricos, adhesivos, trajes de buceo, pezones para biberones, revestimientos que neutralizan las vibraciones; y sobre todo se usa, junto con su versión sintética, el caucho de isopreno, para la producción masiva de neumáticos.
El isopreno, al igual que los polisoprenos, puede mezclarse con otros polímeros, tales como los cauchos de estireno-butadieno o de solo butadieno, para producir materiales todavía más resistentes y duraderos. Es decir, se usa para la síntesis de varios copolímeros elásticos.
Fuera de la industria del caucho, el isopreno se destina como material de partida para la síntesis de vitaminas, saborizantes, esteroides, fragancias y cualquier otra sustancia isoprenoide que resulte más viable sintetizarla que obtenerla de fuentes naturales.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Isoprene. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Isoprene. PubChem Compound Summary for CID 6557. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Isoprene. ScienceDirect. Recuperado de: sciencedirect.com
- Polymer Properties Database. (2020). Isoprene Rubber: Properties and Applications. Recuperado de: polymerdatabase.com
