Examen coproparasitoscópico: toma de muestra, técnicas, ejemplos
El examen coproparasitoscópico es un estudio de laboratorio en el que se examina la materia fecal (heces) con el objeto de detectar parásitos intestinales. Es una de las técnicas de laboratorio más sencilla y antigua, siendo desarrollada inicialmente por Anton Van Leeuwenhoek en el siglo XVIII.
Anton Van Leeuwenhoek, considerado el padre de la microbiología, utilizó el método coproparasitoscópico “directo” para observar sus propias heces y describió lo que años después fue identificado como los trofozoítos de Giardia lamblia, un protozoario que invade el intestino delgado del hombre.
Las enfermedades parasitarias afectan a millones de personas en el mundo, sobre todo en los países pobres o poco desarrollados, donde existen condiciones sanitarias deficientes relacionadas con la disposición de excretas y el consumo de aguas contaminadas.
El diagnóstico de estas enfermedades es importante para un tratamiento adecuado, siendo el examen coproparasitoscópico es una herramienta indispensable para el mismo. Es un examen de laboratorio sencillo, rápido y económico.
El examen coproparasitoscópico incluye varias técnicas que, además de permitir la visualización directa y la cuantificación de huevos, trofozoítos, quistes o larvas, permite identificar las estructuras del microorganismo y así identificar al parásito.
Entre las técnicas utilizadas para el examen coproparasitoscópico se encuentran las técnicas de tinción con azul de metileno, los métodos de concentración, la técnica de Faust, Richie, las técnicas de sedimentación y los exámenes directos, únicos o seriados.
Índice del artículo
Para realizar este estudio se requiere que el paciente tome una muestra fresca de heces que no esté contaminada con orina, agua, sangre (menstrual) o tierra. La muestra debe ser del tamaño de una nuez o, en caso de ser líquida, debe ser, como mínimo, del volumen correspondiente a dos cucharadas.
El paciente no debe haber tomado medicamentos parasiticidas por lo menos en los tres días previos a la toma de la muestra o por el período que le indique su médico. Tampoco debe usar medicamentos laxantes.
Las muestras se deben colocar en un recipiente seco, de boca ancha y con tapa o en un recipiente desechable diseñado para tal fin (que puede obtenerse en la farmacia de su preferencia). Las muestras deben colocarse en un ambiente fresco, no deben ser refrigeradas por más de 24 horas y no pueden conservarse cerca de fuentes térmicas ni congelarse.
Cuando el examen indicado es seriado, se requiere de por lo menos tres muestras, las cuales deben tomarse cada 24 horas o más, según lo indique el médico. Para estos casos, los laboratorios generalmente proveen de un set de frascos que contienen unas soluciones con conservadores.
Cuando en la deposición el paciente observa algún “gusano”, de ser posible, deberá colocarlo en un frasco cerrado con agua y llevarlo al laboratorio junto con el frasco de la muestra de heces.
Los frascos con las muestras o con los “gusanos” deben ser etiquetados e identificados con el nombre del paciente, su edad, sexo y la fecha y hora de la toma de muestra.
Es muy importante instruir adecuadamente al paciente sobre todos estos aspectos de la toma y el manejo de las muestras, ya que de ello depende que los elementos que puedan existir en dicha muestra se mantengan viables para su observación, identificación y diagnóstico.
Existen exámenes coproparasitoscópicos directos y técnicas de suspensión y concentración de las muestras que se utilizan muchas veces para evitar falsos negativos y observar muestras mucho más limpias. También se usan algunas técnicas de tinción para la identificación de ciertos parásitos.
El examen coproparasitoscópico directo, por la técnica de la gota pendiente, consiste en hacer una dilución de la muestra de heces con solución fisiológica (ClNa al 0,9%) y colocar una gota de esa solución en una concavidad que posee un portaobjetos especial usado para tal fin.
Una vez colocada la gota en el portaobjetos se cubre con un cubreobjetos y se observa en el microscopio. Esta técnica permite observar huevos y quistes, pero también permite observar cualquier elemento móvil como flagelados, larvas, trofozoítos, ciliados, etc.
Las técnicas de suspensión utilizan una solución más densa que los elementos que se quieren observar, de manera que estos flotan en la superficie del líquido y pueden colectarse, ya que quedan concentrados en la capa superficial de la solución.
Esta técnica tiene la ventaja que permite tener una muestra bastante limpia de detritus, puesto que estos, al ser más densos, quedan en el fondo del frasco. La desventaja relativa es que la solución encoge y deforma los microorganismos en poco tiempo.
Estos métodos no se usan para huevos de helmintos y cestodos porque son muy pesados y no flotan en estas soluciones. Son muy utilizados para observar protozoarios en su forma tropozoitica o sus huevos y para la observación de larvas como, por ejemplo, las de Strongyloides stercoralis.
Otra técnica muy utilizada por no deformar los microorganismos de la muestra y ser sencilla y económica es la técnica de sedimentación con formalina.
Entre las técnicas de concentración se puede citar como ejemplo a las técnicas de Faust y de Richie.
Las diferentes técnicas que permiten la visualización microscópica de los huevos, larvas u otros elementos de los diferentes parásitos intestinales, combinadas con las técnicas de tinción, permiten la identificación y el diagnóstico de estas enfermedades.
A continuación, se describe un caso clínico y se muestran unas imágenes que permiten ilustrar la utilidad del examen coproparasitoscópico para el diagnóstico y la evaluación de los beneficios del tratamiento.
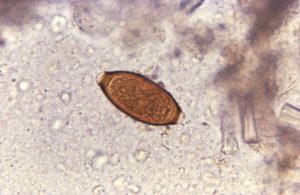
Un paciente masculino de 18 años acude a la consulta médica por presentar dolor abdominal tipo cólico, más intenso en la zona periumbilical, náuseas y episodios de diarrea acuosa.
Al interrogar al paciente, el médico nota dos puntos resaltantes: 1) el paciente refiere haberse bañado en un lago de una zona rural y 2) le llama la atención que sus heces flotan en el váter. Después de examinar al paciente, el médico sospecha la presencia de Giardia lamblia.
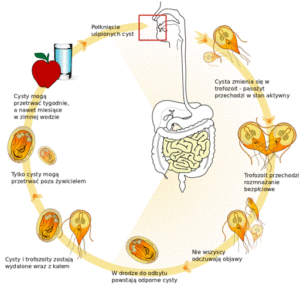
Este protozoario se aloja en el intestino delgado del hombre e interfiere con la absorción de las grasas, lo que genera heces muy grasosas que tienden a flotar. La contaminación frecuentemente ocurre por aguas contaminadas en lagos o arroyos en zonas rurales o en piscinas o jacuzzis con pobre mantenimiento.
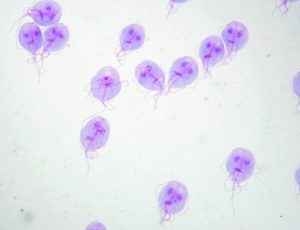
El médico indica un examen coproparasitoscópico y los resultados confirman la presencia de Giardia lamblia. Después de finalizado el tratamiento se indica otro examen coproparasitoscópico que confirma la ausencia de quistes o trofozoítos de Giardia lamblia.
- Buonfrate, D., Mena, M. A., Angheben, A., Requena-Mendez, A., Muñoz, J., Gobbi, F., … & COHEMI Project Study Group. (2015). Prevalence of strongyloidiasis in Latin America: a systematic review of the literature. Epidemiology & Infection, 143(3), 452-460.
- de Haro Arteaga, I., & Ruiz, A. E. C. (2014). Diagnóstico de. Parasitología médica (4a, 347.
- Mendoza, D., Nunez, F. A., Escobedo, A. A., Pelayo, L., Fernandez, M., Torres, D., & Cordovi, R. A. (2003). Usefulness of 2 coproparasitological methods and their utilization in an antigiardiasis therapeutic trial. Revista cubana de medicina tropical, 55(3), 174-178.
- Price, -D. L. (2017). Procedure manual for the diagnosis of intestinal parasites. CRC Press.
- Sahin, I., Kiliç, H., Ozcan, M., & Orhan, R. (1984). A copro-parasitological study on the wrestlers of the national team. Mikrobiyoloji bülteni, 18(2), 114-118.
