Hibridación del carbono: concepto, tipos y sus características
La hibridación del carbono implica la combinación de dos orbitales atómicos puros para formar un nuevo orbital molecular “híbrido” con características propias. La noción de orbital atómico da una mejor explicación que el concepto anterior de órbita, para establecer una aproximación de dónde hay mayor probabilidad de hallar un electrón dentro de un átomo.
Dicho de otra forma, un orbital atómico es la representación de la mecánica cuántica para dar una idea de la posición de un electrón o par de electrones en una zona determinada dentro del átomo, donde cada orbital se define de acuerdo con los valores de sus números cuánticos.
Los números cuánticos describen el estado de un sistema (como el del electrón dentro del átomo) en determinado momento, por medio de la energía perteneciente al electrón (n), el momento angular que describe en su movimiento (l), el momento magnético relacionado (m) y el giro del electrón mientras se desplaza dentro del átomo (s).
Estos parámetros son únicos para cada electrón en un orbital, por lo que dos electrones no pueden tener exactamente los mismos valores de los cuatro números cuánticos y cada orbital puede ser ocupado por dos electrones como máximo.
Índice del artículo
Para describir la hibridación del carbono debe tomarse en cuenta que las características de cada orbital (su forma, energía, tamaño, etc.) dependen de la configuración electrónica que tenga cada átomo.
Es decir, las características de cada orbital dependen de la disposición de los electrones en cada “capa” o nivel: desde el más cercano al núcleo hasta el más externo, conocido también como capa de valencia.
Los electrones del nivel más externo son los únicos disponibles para formar un enlace. Por lo tanto, cuando se forma un enlace químico entre dos átomos se genera el solapamiento o superposición de dos orbitales (uno de cada átomo) y esto está estrechamente relacionado con la geometría de las moléculas.
Como se dijo anteriormente, cada orbital puede ser llenado con un máximo de dos electrones pero debe seguirse el Principio de Aufbau, por medio del cual los orbitales se van llenando de acuerdo con su nivel energético (desde el menor hasta el mayor), como se muestra a continuación:

De esta manera, primero se llena el nivel 1s, luego el 2s, seguido del 2p y así sucesivamente, dependiendo de cuántos electrones posee el átomo o ión.
Así, la hibridación es un fenómeno correspondiente a las moléculas, puesto que cada átomo puede aportar solo orbitales atómicos puros (s, p, d, f) y, debido a la combinación de dos o más orbitales atómicos, se forma la misma cantidad de orbitales híbridos que permiten los enlaces entre elementos.
Los orbitales atómicos tienen distintas formas y orientaciones espaciales, aumentando en complejidad, tal y como se muestra a continuación:
Se observa que existe un solo tipo de orbital s (forma esférica), tres tipos de orbital p (forma lobular, donde cada lóbulo está orientado sobre un eje espacial), cinco tipos de orbital d y siete tipos de orbital f, donde cada tipo de orbital posee exactamente la misma energía que los de su clase.
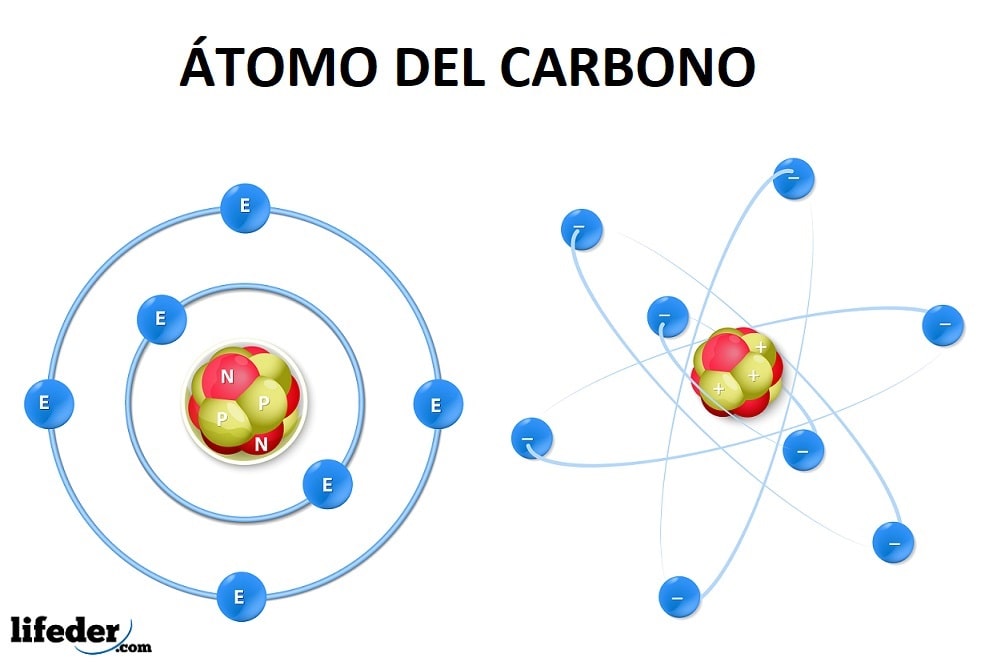
El átomo de carbono en su estado fundamental posee seis electrones, cuya configuración es 1s22s22p2. Es decir, deberían ocupar el nivel 1s (dos electrones), el 2s (dos electrones) y parcialmente el 2p (los dos electrones restantes) de acuerdo al Principio de Aufbau.
Esto quiere decir que el átomo de carbono solo posee dos electrones desapareados en el orbital 2p, pero así no es posible explicar la formación ni geometría de la molécula de metano (CH4) u otras más complejas.
Así que para formar estos enlaces se necesita la hibridación de los orbitales s y p (para el caso del carbono), para generar nuevos orbitales híbridos que expliquen incluso los enlaces dobles y triples, donde los electrones adquieren la configuración más estable para la formación de las moléculas.
La hibridación sp3 consiste en la formación de cuatro orbitales “híbridos” a partir de los orbitales 2s, 2px, 2py y 2pz puros.
Así, se tiene el rearreglo de los electrones en el nivel 2, donde existen cuatro electrones disponibles para la formación de cuatro enlaces y se ordenan de forma paralela para tener menor energía (mayor estabilidad).
Un ejemplo es la molécula de etileno (C2H4), cuyos enlaces forman ángulos de 120° entre los átomos y le proporcionan una geometría trigonal plana.
En este caso se generan enlaces simples C-H y C-C (debido a los orbitales sp2) y un enlace doble C-C (debido al orbital p), para formar la molécula más estable.
A través de la hibridación sp2 se generan tres orbitales “híbridos” a partir del orbital 2s puro y tres orbitales 2p puros. Además, se obtiene un orbital p puro que participa en la formación de un enlace doble (llamado pi: “π”).
Un ejemplo es la molécula de etileno (C2H4), cuyos enlaces forman ángulos de 120° entre los átomos y le proporcionan una geometría trigonal plana. En este caso se generan enlaces simples C-H y C-C (debido a los orbitales sp2) y un enlace doble C-C (debido al orbital p), para formar la molécula más estable.
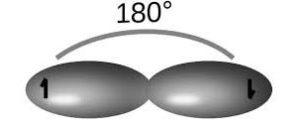
Mediante la hibridación sp se establecen dos orbitales “híbridos” a partir del orbital 2s puro y tres orbitales 2p puros. De esta manerase forman dos orbitales p puros que participan en la formación de un enlace triple.
Para este tipo de hibridación se presenta como ejemplo la molécula de acetileno (C2H2), cuyos enlaces forman ángulos de 180° entre los átomos y le proporcionan una geometría lineal.
Para esta estructura se tienen enlaces simples C-H y C-C (debido a los orbitales sp) y un enlace triple C-C (es decir, dos enlaces pi debido a los orbitales p), para obtener la configuración con menor repulsión electrónica.
- Orbital hybridisation. Recuperado de en.wikipedia.org
- Fox, M. A., y Whitesell, J. K. (2004). Organic Chemistry. Recuperado de books.google.co.ve
- Carey, F. A., y Sundberg, R. J. (2000). Advanced Organic Chemistry: Part A: Structure and Mechanisms. Recuperado de books.google.co.ve
- Anslyn, E. V., y Dougherty, D. A. (2006). Modern Physical Organic Chemistry. Recuperado de books.google.co.ve
- Mathur, R. B.; Singh, B. P., y Pande, S. (2016). Carbon Nanomaterials: Synthesis, Structure, Properties and Applications. Recuperado de books.google.co.ve
