Carbonato de calcio: estructura, propiedades, formación, usos
El carbonato de calcio es un compuesto inorgánico cuya fórmula química es CaCO3. Se encuentra principalmente en minerales como la calcita y la aragonita. Asimismo, compone la piedra caliza, una roca sedimentaria en la que está presente el mineral calcita.
Este importante carbonato metálico se obtiene industrialmente mediante la extracción y molienda de los minerales que lo contienen; con este fin se usa principalmente el mármol. Otro proceso radica en el uso del óxido de calcio, el cual se convierte en hidróxido de calcio, precipitándose el carbonato calcio de mediante la adición de dióxido de carbono. De esta manera se obtienen cristales de un amplio intervalo de tamaños.

También pueden usarse para la producción industrial de CaCO3, en pequeña escala, las conchas de las almejas, las cáscaras de huevo y las conchas de ostras en las que está presente.
El carbonato de calcio presente en la piedra caliza es disuelto por el dióxido de carbono en el agua, generándose el bicarbonato de calcio. Esta acción puede originar las cavernas y es una causa de la alcalinación del agua; evento de gran importancia en el mantenimiento de la vida en ella.
Ha sido utilizado en la construcción y elaboración de esculturas; ejemplos de ello son el Partenón de Atenas, la Catedral de Cracovia, y la escultura de Abraham Lincoln en Washington. Sin embargo, su susceptibilidad a la lluvia ácida ha disminuido su uso en la construcción.
El carbonato de calcio ha tenido múltiples aplicaciones en la industria como material de relleno de plástico y papel. En la medicina se ha usado para controlar la acidez gástrica; como suplemento dietético de calcio; para controlar la fosfatemia en pacientes con insuficiencia renal crónica, etc.
Índice del artículo
- 1 Estructura
- 2 Propiedades
- 2.1 Otros nombres
- 2.2 Masa molar
- 2.3 Descripción física
- 2.4 Sabor
- 2.5 Puntos de fusión y ebullición
- 2.6 Solubilidad
- 2.7 Densidad
- 2.8 Descomposición
- 2.9 pH
- 2.10 Índice de refracción
- 2.11 Incompatibilidades
- 2.12 Entalpía de fusión
- 2.13 Constante del producto de solubilidad
- 2.14 Dureza
- 2.15 Transiciones de fase
- 2.16 Reactividad
- 3 Formación
- 4 Formas del carbonato de calcio
- 5 Usos
- 6 Referencias
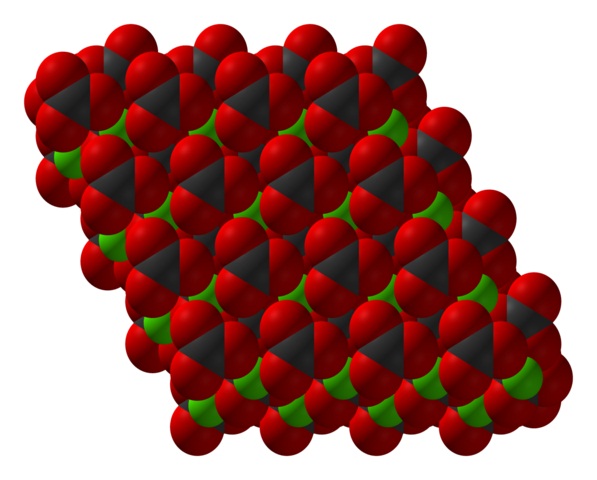
La fórmula del carbonato de calcio, CaCO3, indica que la proporción entre los iones Ca2+ y CO32- es 1:1; es decir, que por cada Ca2+ hay un CO32- de contraparte interaccionando electrostáticamente con él. Así, el enlace iónico termina por disponer estos iones para formar patrones estructurales que definen un cristal.
En la imagen superior se muestra la estructura del CaCO3. Las esferas verdes corresponden a los cationes Ca2+, y las esferas rojas y negras a los aniones CO32-. Nótese que la estructura parece estar formada por múltiples capas: una de calcio, y otra de carbonato; lo que significa que cristaliza en una estructura hexagonal compacta.
Esta fase hexagonal (β-CaCO3) corresponde a un polimorfo. Existen otros dos: el ortorrómbico (λ-CaCO3) y una hexagonal aún más densa (μ-CaCO3). La imagen inferior ayuda a visualizar mejor el dichoso hexágono:
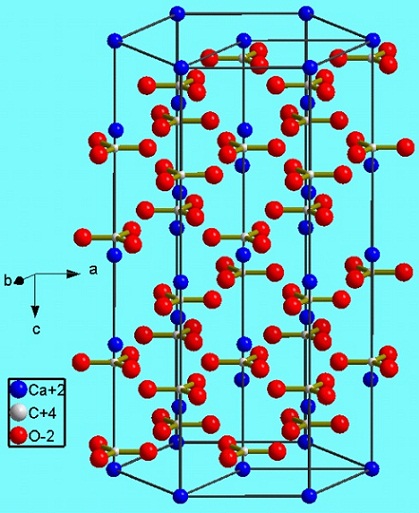
Sin embargo, dependiendo de la temperatura (y para esta sal en menor grado la presión) los iones en sus vibraciones se reajustan a otras estructuras; estas son los polimorfos ya mencionados (β, λ y μ).
Tal como suenan no son muy conocidas, a menos que se les mencionen con sus nombres mineralógicos en un próximo apartado.
Los cristales de CaCO3 no están solos: pueden hospedar impurezas como otros cationes metálicos que los tiñen de colores; o proteínas, incorporando una matriz orgánica que de alguna manera contribuye a su dureza natural.
Las proteínas disminuyen la tensión que experimentan los cristales entre sí ante una presión o impacto. ¿Cómo? Al intercalarse entre los cristales, actuando como si fuera una “almohadilla” (parecido al conjunto ladrillo-cemento-ladrillo).
Es por eso que este compuesto o mineral es biocompatible, y no se extraña que forme parte de las uñas, conchas marinas, caparazones o huesos de los erizos. Ha sido una fuente de inspiración para quienes se dedican a desarrollar nuevos materiales.
-Aragonito
-Calcito
-Volterito
-Leche de calcio
-Tiza
-Mármol
100,086 g/mol.
Polvo blanco inodoro.
Semejante a la tiza, insípido.
Se descompone debido a que libera CO2 antes de siquiera derretirse o hervir.
Prácticamente insoluble en agua y alcohol. Se disuelve con efervescencia en los ácidos acético y clorhídrico diluidos. Los hidróxidos sin embargo reducen su solubilidad. Mientras, las sales de amonio y el dióxido de carbono incrementan la solubilidad del carbonato de calcio en agua.
2,7 a 2,95 g/cm3.
Alrededor de 825 ºC se descompone en óxido de calcio (cal) y dióxido de carbono (CO2).
8 a 9
-1,7216 a 300 nm y 1,6584 a 589 nm (calcita).
-1,5145 a 300 nm y 1,4864 a 589 nm (aragonita).
Con ácidos, alumbre y sales de amonio.
36 kJ/mol a 800 ºC (calcita).
3,36·10-9 a 25 ºC.
-3,0 (calcita)
-3,5 – 4,0 (aragonita) en la escala Mohs.
La aragonita es metaestable y cambia irreversiblemente a calcita cuando se la calienta en aire seco a 400 ºC.
El carbonato de calcio reacciona con los ácidos, liberando dióxido de carbono, calcio iónico y agua.
El carbonato de calcio se combina con agua saturada con dióxido de carbono, equivalente a ácido carbónico (H2CO3), para formar el bicarbonato de calcio.
La tiza, el mármol y la piedra caliza, los dos primeros minerales y un material rocoso el tercero, contienen carbonato de calcio y son de origen sedimentario, Se piensan que se formaron por la sedimentación de caracoles durante millones de años.
El pH podría ser el factor más importante en la formación de los polimorfos a una temperatura de 24 ºC. La vaterita es el producto principal en una gama de pH entre 8,5 y 10; la aragonita lo es a pH 11; y la calcita a pH>12.
Asimismo, se sabe que muchas algas de agua dulce construyen cristales de calcita cuando crecen en un ambiente saturado de calcio. Además, las microalgas son capaces de provocar la precipitación del carbonato de calcio.
En las imágenes a continuación se mostrarán las tres formas o polimorfos principales para el carbonato de calcio:



De arriba hacia abajo están los polimorfos calcita, aragonita y vaterita. Nótese a primera vista la diferencia entre la morfología de sus cristales (el color es propio de sus orígenes y características de sus entornos).
La vaterita es más opaca que la calcita, llegando esta última incluso a ser completamente transparente (espato de Islandia) y, por lo tanto, se ha usado en joyerías y en aplicaciones ópticas. Mientras, los cristales de la aragonita se asemejan a pequeños monolitos alargados.
De observarse muestras de estos tres polimorfos bajo el microscopio electrónico, sus cristales (de tonalidades grisáceas debido a que la técnica no permite la resolución del color), se hallarían las mismas morfologías que en escalas macroscópicas; es decir, a simple vista.
Entre estos tres polimorfos, la calcita es la más abundante y estable, seguida de la aragonita, y por último la vaterita, la más rara de las formas del CaCO3
El carbonato de calcio aumenta la resistencia a la torsión y tracción del caucho sintético y natural, manteniendo su flexibilidad. Se utiliza en la industria de la construcción como ingrediente del cemento y como materia prima para la cal. Se ha disminuido su uso porque es dañado por la lluvia ácida.
El carbonato de calcio se usa en la purificación del hierro. Bajo la forma de cal elimina el dióxido de azufre presente en el metal. Se emplea en la purificación del azúcar de la remolacha. Se llegó a utilizar como tiza para pizarra, pero ha sido sustituido por el yeso para esta aplicación.
El carbonato de calcio se mezcla con la masilla que se emplea en la colocación de vidrios. Molido se usa como material de relleno en la película microporosa empleada en los pañales. También se usa como material de relleno en plásticos como el PVC. Además, aumenta la fortaleza del plástico.
El carbonato de calcio es utilizado para aumentar la capacidad de cubrimiento de las pinturas. Se emplea como material de relleno del papel por ser más económico que la fibra de madera, pudiendo representar más del 10% del papel.
Es empleado como antiácido para combatir la hiperacidez gástrica y aliviar la indigestión. Se usa como suplemento dietético de calcio y en el tratamiento y prevención de la osteoporosis. Se emplea en el tratamiento de la hiperfosfatemia en los pacientes con insuficiencia renal crónica.
Ha sido empleado para reducir los efectos indeseables de los inhibidores de proteasas utilizados en el tratamiento del HIV, observándose en los pacientes una reducción en la diarrea.
Produce una disminución de la presión arterial en mujeres embarazadas con hipertensión y preeclampsia, ya que ambas podrían estar asociadas a un aumento de la demanda de calcio debido a la presencia fetal.
El carbonato de calcio es utilizado en la agricultura como fertilizante y para combatir la acidez del suelo. Es empleado como conservante, retenedor del color, y reafirmante de los alimentos.
Además, es un ingrediente de la pasta dental, y sirve como abrasivo en forma de polvo en la limpieza y lavado.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Calcium carbonate. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Calcium carbonate. PubChem Database., CID=10112. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Kai-Yin Chong, Chin-Hua Chia, and Sarani Zakaria. (2014). Polymorphs Calcium Carbonate on Temperature Reaction. AIP Conference Proceedings 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (01 de noviembre de 2016). Discovering How Calcium Carbonate Crystals Get Strength. Advantage Business Marketing. Recuperado de: rdmag.com
- American Elements. (2019). Calcium carbonate. Recuperado de: americanelements.com
- ElSevier. (2019). Calcium carbonate. ScienceDirect. Recuperado de: sciencedirect.com
- Chemical Book. (2017). Calcium carbonate. Recuperado de: chemicalbook.com
