Gliceraldehído: estructura, características, funciones
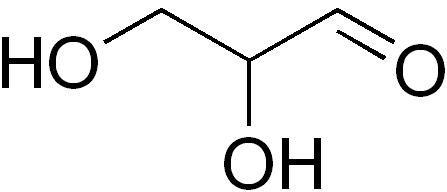
El gliceraldehído es el único monosacárido de tres carbonos, siendo a su vez la única triosa. Se trata también de una aldotriosa porque posee un grupo aldehido. La palabra gliceraldehído proviene de la combinación glicerina y aldehido. Esto se debe a que el gliceraldehído es similar a la glicerina, pero el carbono uno (C-1) es un aldehido.
La síntesis química de gliceraldehído se lleva a cabo mediante métodos diferentes, por ejemplo, usando enzimas. El gliceraldehído es una molécula bastante reactiva, pudiendo formar entrecruzamientos entre proteínas.
Índice del artículo
El gliceraldehído posee un centro asimétrico o quiral (el átomo de carbono 2, C-2). Forma dos enantiómeros D (dextrógiro) y L (levógiro), que rotan el plano de la luz polarizada en direcciones opuestas: el D-gliceraldehído lo gira hacia la derecha y el L-gliceraldehído hacia la izquierda.
La rotación óptica específica del D-gliceraldehído, a 25 ºC, es de +8,7º, y la rotación óptica específica del D-gliceraldehído, a 25 ºC, es de -8,7º. El D-gliceraldehído se encuentra frecuentemente en la naturaleza, principalmente como gliceraldehído 3-fosfato.
La configuración del L-gliceraldehído se usa cómo referencia estándar para los carbohidratos. En las moléculas biológicas abundan los D-azúcares. El átomo de carbono 3 (C-3) del gliceraldehído es un grupo hidroximetileno (-CH2OH).
Los cristales de gliceraldehído son incoloros y tienen sabor dulce. La fórmula empírica de este azúcar es C3H6O3 y su peso molecular es 90 g/mol.
En solución acuosa, el DL-gliceraldehído está presente principalmente como aldehidrol, que es una forma hidratada del aldehido. El DL-gliceraldehído cristalino es dimérico.
El análisis de los cristales de gliceraldehído mediante rayos X ha demostrado que posee anillos de 1,4-dioxano con todos los sustituyentes en la orientación ecuatorial.
En solución acuosa, el gliceraldehído experimenta autooxidación generando radicales libres de 1-hidroxialquil e intermediarios de reducción de dioxígeno, tales como superóxido, peróxido de hidrógeno y radicales hidroaxil. Ello está asociado con el consumo rápido de oxígeno.
La velocidad de consumo de oxígeno disminuye lentamente en presencia de dismutasa superóxido. Esto sugiere que hay formación de superóxido durante la autooxidación de gliceraldehído. El paso limitante de la autoxidación del gliceraldehído es la velocidad de enolizacióngliceraldehído
La síntesis de D-gliceraldehído es catalizada por aminoácidos primarios y secundarios, siendo favorecida a valores de pH bajos (de 3 a 4).
La interacción proteína-proteína es un mecanismo molecular de múltiples procesos biológicos complejos. Estas interacciones pueden ser transitorias, tratarse de la interacción de proteínas de una vía metabólica o de la traducción de la señal.
Los entrecruzamientos químicos constituyen un método directo para identificar las interacciones proteína-proteína transitorias y estables.
La técnica de entrecruzamientos entre proteínas consiste en la formación de enlaces covalentes, para lo cual se usan agentes que poseen grupos reactivos bifuncionales que reaccionan con los grupos aminos y sulfhidrilos de residuos de aminoácidos de las proteínas.
Específicamente, los agentes reaccionan con los grupos aminos primarios (tales como el épsilon-amino de los residuos de las lisinas) y forman entrecruzamientos tanto en el interior de una subunidad de las proteínas como entre subunidades de proteínas.
Existe una gran variedad de agentes entrecruzadores disponibles comercialmente. Aunque el gliceraldehído es un agente entrecruzador, hay otros agentes más populares, tales como el glutaraldehido. Esto se debe a que el glutaraldehido mantiene la rigidez estructural de la proteína, lo cual es un requisito importante en muchos estudios.
Otros agentes populares son imidoésteres homobifuncionales, que varían en la longitud del brazo espaciador entre sus grupos reactivos. Algunos ejemplos de imidoésteres son el dimetil apimidato (DMA), el dimetil suberimidato (DMS) y el dimetil pimilimidato (DMP).
Las microesferas de gelatina tienen el potencial de servir para la liberación controlada de drogas. Ello se debe a que estas microesferas no son tóxicas y a que sus productos son fácilmente excretados. Sin embargo, la gelatina es un polímero soluble, por lo cual debe ser modificada químicamente para servir como sistema de envío de drogas.
El D,L-gliceraldehído puede ser considerado un agente de entrecruzamiento no tóxico (la dosis letal, DL50 i.p. en ratas es 2000 mg/Kg). Además, en el cuerpo humano, el D-gliceraldehído es fosforilado mediante la triosa quinasa. De esta manera, se forma el gliceraldehído 3-fosfato que entra a la glicólisis.
El tratamiento de las microesferas de gelatina con D,L-gliceraldehído durante 24 horas produce microesferas con un número de residuos de aminoácidos de lisina libres reducido. Por ello, se ha evaluado la capacidad de las microesferas para prolongar, por ejemplo, el efecto del hidroclururo de clodinina, que es antihipertensivo.
Las microesferas fueron administradas mediante inyección subcutánea a cobayas albinas y ratas. Luego de la inyección, la presión sanguínea sistólica disminuyó durante dos horas, recuperando posteriormente su valor basal. Los tejidos del lugar de inyección fueron analizados y no se encontraron microesferas, aunque se observó inflamación.
En las condiciones prebióticas – como las que se supone tuvo la Tierra primitiva – el formaldehído podría haber servido para la síntesis de gliceraldehído, un intermediario químico implicado en los procesos químicos que pudieran haber originado la vida.
La hipótesis anterior se basa en el hecho de que tanto la glicólisis como la fotosíntesis tienen como intermediario metabólico al gliceraldehído 3-fosfato.
Se ha propuesto un modelo químico que explica la biosíntesis de gliceraldehído a partir de formaldehído mediante una vía cíclica. La síntesis de gliceraldehído tiene lugar por adición de formaldehído a una triosa (gliceraldehído ↔ dihidroxiacetona) para producir una tetrosa (cetotetrosa ↔ aldotetrosa), produciéndose glicoaldehido, precursor del gliceraldehído.
La adición de formaldehído al glicoaldehido completa el ciclo. Se produce la síntesis de dos moléculas de triosa a partir de seis moléculas de formaldehído.
Por lo general, la síntesis prebiótica de azúcares se cree que está implicada la reacción de Formosa, en el cual el formaldehído en la presencia de una pequeña cantidad de glicoaldehido es convertido en azúcares mediante reacciones de condensación aldólicas.
Se ha propuesto que la oxidación prebiótica de azúcares (glicoaldehido, triosas, tetrosas) produjo polihidroxiacidos que actúan como sustancias autocatalíticas.
La conversión de gliceraldehído en ácido láctico y ácido glicérico, oxido dependiente del hidróxido de hierro, apunta a que los oligoésteres de estos hidroxiácidos tuvo lugar en la superficie de este material.
- Breslow, R., Ramalingam, V., Appayee, C. 2013. Catalysis of glyceraldehyde synthesis by primary or secondary amino acids under prebiotic conditions as a function of pH. Origen Life Evolution Biosphera. DOI 10.1007/s11084-013-9347-0.
- Carey, F. A., Giuliano, R. M. 2016. Organic chemistry. McGraw-Hill, Nueva York.
- Robyt, J.F. 1998. Essentials of Carbohydrate Chemistry. Springer, New York.
- Thornalley, P., Wolff, S., Crabbe, J., Stern, A. 1984. The autoxidation of glyceraldehyde and other simple monosaccharides under physiological conditions catalyzed by buffer ions. Biochimica et Biophysica Acta, 797, 276–287.
- Vandelli, M.A., Rivas, F., Guerra, P., Forni, F., Arletti, R. 2001. Gelatin microspheres crosslinked with D,L-glyceraldehyde as a potential drug delivery system: preparation, characterization, in vitro and in vivo studies. International Journal of Pharmaceutics, 215, 175–184.
- Weber, A.L. 1987. The triose model: glyceraldehyde as a source of energy and monomers for prebiotic condensation reactions. Origins of Life, 17, 107–119.
