Linfocitos T CD4: estructura, funciones, maduración
Los linfocitos T CD4 son un tipo de linfocito T que tiene funciones principalmente como célula “accesoria” o “colaboradora” durante la respuesta inmune específica o adaptativa. Se caracterizan por la presencia de un receptor de membrana conocido como el “complejo receptor de las células T”, abreviado como TCR (del inglés T Cell Receptor). Sin embargo, existen diferentes subpoblaciones de células T que se identifican por la presencia de otras moléculas marcadoras de membrana.
Estas moléculas son de naturaleza proteica y se conocen como parte de un “grupo de diferenciación” o CD (del inglés Cluster of Differentiation). De acuerdo con esto, las células T pueden dividirse en dos grupos principales: los linfocitos T CD4 y los linfocitos T CD8.

Estos últimos son también conocidos como “células T citotóxicas” puesto que, en la respuesta inmune humoral, intervienen directamente en la eliminación de células invadidas por virus o microorganismos intracelulares.
Los linfocitos T CD4 son popularmente conocidos en la literatura como “linfocitos T colaboradores”, pues participan en la activación de otros linfocitos del sistema inmune: los linfocitos B. Su participación promueve tanto la activación como la producción y secreción de anticuerpos.
Índice del artículo
Los linfocitos T CD4 comparten las características estructurales de cualquier otra célula del linaje linfoide. Poseen un núcleo prominente, lo que confina el citosol a un estrecho anillo entre su membrana plasmática y el núcleo.
No poseen demasiados orgánulos internos, pero en las micrografías electrónicas se parecían algunas mitocondrias, un pequeño complejo de Golgi, ribosomas libres y unos cuantos lisosomas.
Estas células se originan en la médula ósea a partir de un precursor común con otras células linfoides como las células B y las células “asesinas naturales” (NK), así como el resto de las células hematopoyéticas.
Sin embargo, su maduración y activación ocurre fuera de la médula ósea, en un órgano conocido como el timo, y pueden ejercer sus funciones en algunos órganos linfoides secundarios como las amígdalas, el apéndice y otros.
Se distinguen de otras células del linaje linfoide por la expresión de marcadores específicos, concretamente el “receptor de células T” (del inglés T Cell Receptor). Estas proteínas de superficie pueden ser contempladas como complejos proteicos que funcionan principalmente en el reconocimiento de antígenos presentados a ellos.
A estas proteínas se asocia otro complejo proteico conocido como CD3, que es requerido para la señalización que tiene lugar durante el reconocimiento de antígenos.
Por otro lado, los linfocitos T colaboradores expresan en su superficie un tipo de molécula “marcadora” conocida como CD4 que, al igual que todas las moléculas de los grupos de diferenciación, reconocen sitios específicos de los receptores “restringidos” por las moléculas MHC de la clase II.
En la literatura pueden encontrarse diferentes nombres para los distintos tipos de linfocitos T con marcadores de tipo CD4, pero destaca un tipo de nomenclatura que discrimina el tipo de citoquina que estas células son capaces de producir.
De esta manera, se han definido varias clases de linfocitos T colaboradores entre las que destacan los linfocitos TH1, los TH2, los TH9, los TH17, TH22, los THF y los Tregs o reguladores.
Los linfocitos TH1 secretan interferón gamma (IFN-γ) una citoquina útil para la activación de otras células del sistema inmune conocidas como macrófagos. Los linfocitos colaboradores de tipo 2 (TH2) secretan una amplia variedad de interleucinas que promueven la producción de anticuerpos.
Los linfocitos T colaboradores foliculares o THF, que se encuentran en los folículos linfoides, participan en la activación de las células B y también “ayudan” en la producción y secreción de anticuerpos dado que secretan abundantes cantidades de citoquinas.
Otra clase de linfocitos colaboradores, los linfocitos T reguladores o Tregs, regulan gran cantidad de funciones celulares a través de contactos célula-célula, de la expresión de moléculas de superficie y de la potenciación de la respuesta a distintos factores de crecimiento.
Con respecto al desarrollo de estos “subconjuntos” de linfocitos T CD4, diferentes estudios han demostrado que estos derivan del mismo precursor de células T, es decir, que no se originan a partir de linajes separados que se comprometen antes de la estimulación antigénica.
Por el contrario, la diferenciación de cada tipo de linfocito colaborador es influenciada por muchos de los aspectos microambientales a los que se somete la célula precursora, que se cree que es un linfocito T CD4 maduro e ingenuo, es estimulado por las citoquinas producidas por macrófagos.
Los linfocitos T CD4 funcionan principalmente como células colaboradoras. Estas son células que se activan y generan respuestas inmunológicas frente a infecciones una vez se encuentran, reconocen e interactúan con un antígeno invasor.
Su capacidad de reconocimiento y unión a antígenos foráneos es considerablemente distinta a la de las células B, pues estas últimas son capaces de reconocer antígenos solubles en su condición de “estado ingenuo”, antes de su completa diferenciación.
En cambio, los linfocitos T (en general) solo pueden reconocer antígenos peptídicos unidos a otras moléculas codificadas por los genes de una familia proteica conocida como “complejo mayor de histocompatibilidad” o MHC (del inglés Major Histocompatibility Complex) y a esto se le llama “restricción por MHC”.
Existen al menos tres clases de proteínas MHC y los linfocitos T CD4 reconocen los antígenos presentados en el contexto de las MHC de la clase II.
Se denominan células T colaboradoras o “helpers” porque “ayudan” a las células B que se caracterizan por la producción de anticuerpos T-dependiente, es decir, que necesitan de la presencia de linfocito T.
Su responsabilidad fundamental radica en la producción de citoquinas solubles que participan en distintos procesos inmunológicos.
Un determinado conjunto de células T CD4 maduras y diferenciadas puede vivir durante periodos de tiempo más prolongados y proporcionar una respuesta más rápida cuando el organismo donde se encuentran se enfrenta al mismo antígeno por segunda vez.
Estas células que se dedican a “recordar” los antígenos que las activaron y que dispararon su diferenciación se conocen como “células T de memoria”.
Los linfocitos T CD4 se originan en la médula ósea y posteriormente migran al timo para diferenciarse y madurar. Las células linfoides progenitoras de los linfocitos T presentes en el timo se conocen como “timocitos”.
Los timocitos pasan por distintas etapas de maduración, en la cual se expresan gradualmente los marcadores membranales que los caracterizan (se hizo referencia previa a los marcadores TCR y CD3).
Durante el proceso de maduración se seleccionan las células T colaboradoras que reconocen antígenos foráneos y se eliminan las que reconocen moléculas propias del organismo que les da origen. Este es un mecanismo muy importante de protección contra la presencia de células “auto reactivas”.
Los linfocitos T inactivos están en un periodo de senescencia mitótica o, lo que es igual, no se dividen activamente y están detenidas en la fase G0 del ciclo celular.
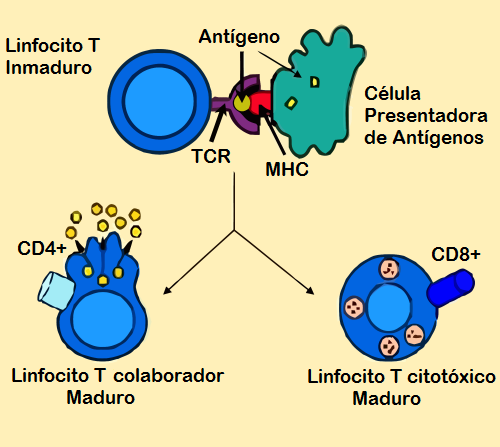
En el proceso de activación participan unas células “accesorias” conocidas como células presentadoras de antígenos o APC (del inglés Antigen Presenting Cells). Dichas células tienen la función de “presentar” los antígenos unidos a las proteínas del MHC de la clase II que son reconocidas selectivamente por los TCR en la membrana de los linfocitos T CD4.
Durante este proceso, que tiene lugar en el timo, los linfocitos se diferencian en linfoblastos, cambiando de forma y de tamaño. Los linfoblastos pueden dividirse y proliferar, multiplicando el número de células en la población.
La interacción entre el receptor TCR (en la superficie de la célula T CD4) y el antígeno unido a la MHC de clase II (en la superficie de la célula APC) forma un complejo que asegura el reconocimiento específico.
Una vez se reconoce el antígeno presentado en el contexto de la MHC de clase II, tanto el linfocito CD4 como la célula APC comienzan a secretar citoquinas que contribuyen a la activación del linfocito.
Cuando el linfocito es activado se multiplica, formando nuevas células idénticas, específicas para el antígeno en cuestión y que se encuentra en estado “ingenuo” o “naïve”, que no se modifica hasta tanto se encuentren con el antígeno para el cual fueron “diseñadas”.
El cuerpo humano, al igual que el de muchos mamíferos, tiene la capacidad de producir cientos de células linfocíticas en periodos muy cortos de tiempo.
Además, puesto que la diferenciación de una célula T implica el reordenamiento aleatorio de los genes que codifican para las proteínas de reconocimiento de los antígenos que le son presentados, se tienen cientos de poblaciones diferentes de células capaces de reconocer diferentes “partes” del mismo antígeno o antígenos distintos.
Esta multitud celular implica ciertos peligros fisiológicos, pues algunos de los patrones reconocidos por los receptores de membrana de las células T podrían coincidir con los patrones de algunas moléculas propias.
Adicionalmente, no todas estas células están destinadas a ejercer sus funciones inmediatamente, pues requieren de la interacción con el antígeno definido.
Así pues, la “homeostasis” linfocitaria es conseguida, en los órganos linfoides primarios, disparando las vías de muerte celular programada en aquellas células que no son necesarias o que no se diferencian y maduran completamente.
- Abbas, A., Murphy, K., & Sher, A. (1996). Functional diversity of helper T lymphocytes. Nature, 383, 787–793.
- Actor, J. K. (2014). Introductory Immunology Basic Concepts for Interdisciplinary Applications. London: Academic Press.
- Bottomly, K. (1988). A functional dichotomy in CD4+ T lymphocytes. Immunology Today, 9(9), 268–274.
- Cavanagh, M. (n.d.). T-cell activation. British Society for Immunology.
- Reinherz, E., Haynes, B., Nadles, L., & Bernstein, I. (1986). Leukocyte Typing II. Human T Lymphocytes (Vol. 1). Springer.
- Smith-Garvin, J. E., Koretzky, G. a, & Jordan, M. S. (2009). T Cell Activation. Annu. Rev. Immunol., 27, 591–619.
