Joseph Thomson: quién fue, biografía y aportes a la ciencia y a la química

Joseph John Thomson (1856-1940) fue un químico británico destacado por diversos aportes, como el descubrimiento del electrón, su modelo atómico, el descubrimiento de los isótopos o el experimento de rayos catódicos. Ganó el premio Nobel de Física en 1906.
Nació en Cheetam Hill, un distrito de Manchester, Inglaterra, el 18 de diciembre de 1856. También conocido como “J.J.” Thomson, estudió ingeniería en Owens College, actualmente parte de la Universidad de Manchester, y luego matemáticas en Cambridge.
En 1890, J.J. Thomson se casó con Rose Elizabeth Paget, hija del médico Sir Edward George Paget, con la cual tuvo dos hijos: una niña, llamada Joan Paget Thomson, y un niño, George Paget Thomson.
Este último se convertiría en un famoso científico, obteniendo en 1937 un premio Nobel de Física por sus trabajos con electrones.
Desde joven, Thomson centró sus estudios en la estructura de los átomos, llegando así a descubrir la existencia de los electrones y los isótopos, entre otros tantos de sus aportes.
En 1906, Thomson recibió el premio Nobel de Física, “en reconocimiento al gran mérito de su investigación teórica y experimental sobre la conducción de electricidad a través de los gases”, como lo estableció el Jurado en el veredicto del mencionado premio.
En 1908, fue nombrado caballero por la Corona británica y ejerció como Profesor Honorario de Física en Cambridge y en el Royal Institute, de Londres.
Murió el 30 de agosto de 1940 a los 83 años, en la ciudad de Cambridge, Inglaterra. El físico fue enterrado en la Abadía de Westminster, cerca de la tumba de Sir Isaac Newton.
Aportes de Joseph Thomson a la ciencia y a la química
Descubrimiento del electrón
En 1897, J.J. Thomson descubrió una nueva partícula más liviana que el hidrógeno, que fue bautizada “electrón”.
El hidrógeno era considerado una unidad de medición de peso atómico. Hasta ese momento, el átomo era la división más pequeña de la materia.
En este sentido, Thomson fue el primero en descubrir las partículas subatómicas corpusculares cargadas negativamente.
Modelo atómico de Thomson
El modelo atómico de Thomson era la estructura que el físico inglés le atribuía a los átomos. Para el científico, los átomos eran una esfera de carga positiva.
Allí se incrustaban los electrones de carga negativa distribuidos uniformemente sobre esa nube de carga positiva, es decir, que neutraliza la carga positiva de la masa del átomo.
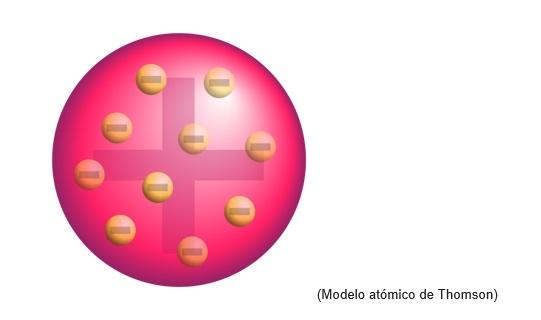
Este nuevo modelo sustituye al elaborado por Dalton y posteriormente será refutado por Rutherford, discípulo de Thomson en los Laboratorios Cavendish, de Cambridge.
Separación de átomos
Thomson utilizó los rayos positivos o anódicos para separar átomos de distinta masa. Este método le posibilitó poder calcular la electricidad transportada por cada átomo y el número de moléculas por centímetro cúbico.
Al poder dividir los átomos de distinta masa y carga, el físico descubrió la existencia de los isótopos. También de este modo, con su estudio de los rayos positivos, produjo un gran avance hacia la espectrometría de masas.
Descubrimiento de los isótopos
J.J. Thomson descubrió que los iones de neón tenían diferentes masas, es decir, diferente peso atómico. Así fue como Thomson demostró que el neón tiene dos subtipos de isótopos, el neón-20 y el neón-22.
Los isótopos, estudiados hasta el día de hoy, son átomos de un mismo elemento, pero sus núcleos tienen diferente número másico, ya que están compuestos por diferentes cantidades de neutrones en su centro.
Experimentos con rayos catódicos
Los rayos catódicos son corrientes de electrones en tubos de vacío, es decir, tubos de cristal con dos electrodos, uno positivo y otro negativo.
Cuando se calienta el electrodo negativo, también llamado cátodo, emite radiación que se dirige hacia el electrodo positivo, o ánodo, en línea recta si no se presenta ningún campo magnético en ese trayecto.
Si las paredes de cristal del tubo están recubiertas de material fluorescente, el golpe de los cátodos contra esa capa produce la proyección de luz.
Thomson estudió el comportamiento de los rayos catódicos y arribó a las conclusiones de que los rayos se propagaban en línea recta.
También concluyó que estos rayos podían ser desviados de su trayectoria por la presencia de un imán, es decir, de un campo magnético. Además, los rayos podían mover las aspas con la fuerza de la masa de los electrones circulando, demostrando así que los electrones tenían masa.
J.J. Thomson experimentó variar el gas dentro del tubo de rayos catódicos, pero no variaba el comportamiento de los electrones. Asimismo, los rayos catódicos calentaban los objetos que se interponían en el camino entre electrodos.
En conclusión, Thomson había demostrado que los rayos catódicos tenían efectos lumínicos, mecánicos, químicos y térmicos.
Los tubos de rayos catódicos y sus propiedades lumínicas fueron trascendentales para la posterior invención de la televisión de tubo (CTR) y las cámaras de vídeos.
Espectrómetro de masas
J.J. Thomson creó una primera aproximación al espectrómetro de masas. Esta herramienta le permitía al científico estudiar la relación masa/carga de los tubos de rayos catódicos, y medir cuánto se desvían por la influencia de un campo magnético y la cantidad de energía que llevan.
Con esta investigación llegó a la conclusión de que los rayos catódicos estaban compuestos de corpúsculos de carga negativa, que están dentro de los átomos, postulando así la divisibilidad del átomo y dando origen a la figura del electrón.
Asimismo, los avances en la espectrometría de masas continuaron hasta la actualidad, evolucionando en distintos métodos para separar los electrones de los átomos.
Además, Thomson fue el primero en sugerir la primera guía de onda en 1893. Este experimento consistía en propagar ondas electromagnéticas dentro de una cavidad cilíndrica controlada, que fue realizada por primera vez en 1897 por Lord Rayleigh, otro premio Nobel de la Física.
Las guías de onda serían muy utilizadas a futuro, incluso en la actualidad, con la transmisión de datos y la fibra óptica.
El legado de Thomson
El Thomson (Th) se estableció como unidad de medida masa-carga en espectrometría de masas, propuesta por los químicos Cooks y Rockwood, en honor a Thomson.
Esta técnica permite determinar la distribución de las moléculas de una sustancia de acuerdo a su masa y, reconocer por esta, cuáles están presentes en una muestra de materia.
Fórmula del Thomson (Th):
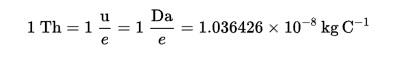
Obras destacadas
- The Discarge of Electricity Through Gases, Conduction of Electricity Through Gases (1900).
- The Corpuscular Theory of Matter, The Electron in Chemistry y Recollections and Reflections (1907).
- Beyond the Electron (1928).
Referencias
- Nobel Media AB (2014). J. Thomson – Biographical. Nobelprize.org. nobelprize.org.
- Thomson, Joseph J., Conduction of electricity through gases. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. El discreto encanto de las partículas elementales.
- Christen, Hans Rudolf, Fundamentos de la química general e inorgánica, Volumen 1. Barcelona, España. Ediciones Reverté S.A., 1986.
- Arzani, Aurora Cortina, Química General Elemental. México, Editorial Porrúa, 1967.
- R. G. Cooks, A. L. Rockwood. Rapid Commun. Mass Spectrom. 5, 93 (1991).
