Índice de yodo: fundamento, procedimiento y aplicaciones
El índice de yodo es la cantidad de yodo que una grasa o aceite absorbe debido a las insaturaciones de sus componentes. Indica la proporción de ácidos grasos insaturados que están presentes.
Se determina mediante una prueba que mide la cantidad de yodo que reacciona bajo ciertas condiciones con los enlaces dobles C=C de los constituyentes de grasas o aceites naturales o procesados.

El número resultante expresa de forma cualitativa la concentración de los ácidos grasos insaturados, por lo que es un parámetro simple y muy útil. Generalmente se abrevia IV (siglas del inglés Iodine Value).
También se le conoce como “número de yodo”, “valor de yodo” o “valor de absorción de yodo” (traducción del inglés iodine number, iodine value y iodine absorption value respectivamente).
El procedimiento original para determinarlo y su nombre se deben al científico Arthur von Hübl, que siendo estudiante del Departamento de Química de la Universidad Técnica de Viena lo desarrolló en 1884.
Se emplea en las fábricas de alimentos procesados, en la determinación de la calidad del biodiesel y en forma general en la caracterización de aceites y grasas.
Índice del artículo
- 1 Fundamento de la prueba
- 2 Procedimiento
- 3 Aplicaciones del índice de yodo
- 4 Alto índice de yodo
- 5 Referencias
El índice de yodo es igual al número de gramos de yodo requeridos para saturar los ácidos grasos insaturados presentes en 100 g de aceite o grasa. Los ácidos grasos insaturados se llaman así porque pueden contener uno o más enlaces dobles C=C.
Cuando se determina el índice de yodo este se agrega al aceite o grasa y reacciona con los dobles enlaces C=C. El enlace doble C=C toma dos átomos de yodo.
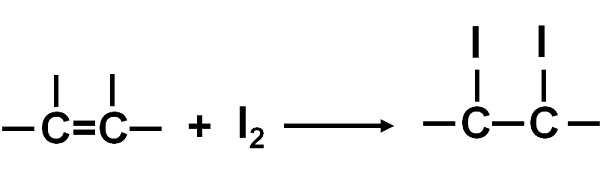
A mayor índice de yodo, mayor cantidad de insaturaciones tiene la muestra.
Los aceites ricos en ácidos grasos saturados tienen índices de yodo bajos, mientras que aceites ricos en ácidos grasos insaturados tienen índices de yodo altos.
Existen varios métodos para medir el IV de grasas y aceites pero los métodos más conocidos son el método de Wijs y el de Hübl.
Arthur von Hübl fue el primero en idear el concepto de número de yodo en 1884.
Para determinarlo se prepara la solución de Hübl, que consiste en yodo (I2) y cloruro mercúrico (HgCl2) disueltos en etanol. La muestra de grasa o aceite se disuelve en cloroformo.

Se agrega la solución de Hübl a la muestra disuelta para que el yodo reaccione con los enlaces dobles. Luego se titula con solución estándar de tiosulfato de sodio (Na2S2O3) para determinar el I2 residual empleando almidón como indicador.
Los resultados se expresan como el número de gramos de yodo absorbidos por 100 g de la muestra de aceite o grasa.
El científico J.J.A. Wijs modificó en 1898 el procedimiento de Hübl cambiando los reactivos iniciales.
Según este método se prepara el reactivo de Wijs disolviendo cloruro de yodo (ICl) en una mezcla de ácido acético y ciclohexano. Este reactivo se añade gota a gota a la muestra disuelta en un solvente.

Wijs consideró que la ventaja de este procedimiento es la formación de ácido hipoyodoso HOI como especie activa.
Cuando ha ocurrido la adición de yodo a los enlaces dobles, el exceso de ICl se reduce a yodo libre (I2) mediante la adición de una solución acuosa de yoduro de potasio (KI).
El yodo así liberado se titula con una solución estándar de tiosulfato de sodio con almidón como indicador.
Se han realizado esfuerzos por implementar procedimientos que no requieran compuestos químicos peligrosos, en especial en las industrias de alimentos.
Los métodos más avanzados emplean instrumentos especializados, tales como equipos de infrarrojo, de resonancia magnética nuclear, calorimetría diferencial y cromatografía de gases.
De estos métodos se obtiene mucha más información y además son más seguros y precisos.
Este parámetro tiene utilidad en diversas áreas. Se usa para la determinación de la calidad del aceite de diversas especies de plantas, para el estudio de los efectos de los insecticidas sobre las plantas y para la determinación de la calidad del combustible diésel derivado de aceites vegetales.
Los aceites con altos IV contienen gran cantidad de ácidos grasos altamente insaturados que pueden sufrir reacciones de rápida degradación tales como autooxidación o polimerización.
La estabilidad térmica de aceites y grasas utilizados en alimentos horneados está conectada con la tendencia a la rancidez (oxidación) y con una mayor participación en la formación de residuos en los moldes de cocción.
Durante procesos de horneado de alimentos las reacciones de oxidación y polimerización ocurren más fácilmente debido a las altas temperaturas y la presencia de oxígeno.
Es por ello que las grasas con un bajo IV son mejores para la cocción de obleas y galletas dulces.
El biodiesel es un combustible usado en motores diésel que se obtiene de aceites y grasas naturales mediante procesos de conversión a ésteres.
El IV es una prueba estándar que sirve para indicar la tendencia a la oxidación del biodiesel. Esta característica es debida a los ácidos grasos poliinsaturados, que son algunos de los compuestos que causan la formación de depósitos en el motor.

Debido a que el punto de fusión y la estabilidad oxidativa están relacionados con el grado de insaturación, el IV proporciona una estimación cualitativa de estas propiedades.
Es un parámetro muy importante en la industria del aceite de palma pues permite seguir el proceso de fraccionamiento.
A continuación el IV de algunos aceites y grasas:
Aceite de maní 82-107; aceite de maíz 103-128; aceite de semilla de algodón 99-113; aceite de coco 7,7-10,5; aceite de palma 44-54; aceite de linaza 155-205; mantequilla 25-42.

Los aceites con índice de yodo mayor a 115 son llamados aceites secantes (del inglés drying oils). El aceite de linaza es un representante de este grupo.
Son aceites que al exponerse al aire durante cierto tiempo se endurecen pues sufren polimerización y forman películas sólidas y resistentes.
Un IV por encima de 150 indica que el aceite seca muy bien y es apto para ser utilizado en tintas de impresión, pinturas, tratamientos superficiales de madera, pisos, etc.

Esto se deriva de la reactividad de los enlaces C–H situados al lado de enlaces C=C. Al tomar un átomo de H de esos sitios se forman radicales libres, seguidamente se adiciona oxígeno para dar radicales peróxido los cuales favorecen la polimerización.
A mayor cantidad de enlaces C=C del aceite mayor es su tendencia a secarse.
- Da Silva Oliveira, W. et al. (2019). Mature chemical analysis methods for food chemical properties evaluation. Iodine value. In Evaluation Technologies for Food Quality. Recuperado de sciencedirect.com.
- Tiefenbacher, K.F. (2017). Technology of Main Ingredients-Sweeteners and Lipids. The Iodine Value Measures the Unsaturation in Oils and Fats. In Wafer and Waffle. Recuperado de sciencedirect.com.
- Chong, C.L. (2012). Measurement and Maintenance of Palm Oil Quality. Iodine Value. In Palm Oil. Recuperado de sciencedirect.com.
- Sanders, T.H. (2003). Ground Nut Oil. Iodine Value. In Encyclopedia of Food Sciences and Nutrition (Second Edition). Recuperado de sciencedirect.com.
- Patterson, H.B.W. (2011). Quality and Control. Iodine Value. In Hydrogenation of Fats and Oils (Second Edition). Recuperado de sciencedirect.com.
- Tiefenbacher K.F. (2019). Glossary of Terms in Wafers, Waffles and Adjuncts. Iodine Value. In The Technology of Wafers and Waffles II. Recuperado de aciencedirect.com.
- Gandini, A. (1989). Supplement 1. Drying Oils. In Comprehensive Polymer Science and Supplements. Recuperado de sciencedirect.com.
- Wikimedia Foundation. (2020). Iodine value. Recuperado de en.wikipedia.org.
- Gupta, R.C. and Kanwar, G. (1994). Determination of Iodine Numbers of Edible Oils. Biochemical Education 22(1) 1994, p.47. Recuperado de onlinelibrary.wiley.com.
- Kyriakidis, N.B. and Katsiloulis, T. (2000). Calculation of Iodine Value from Measurements of Fatty Acid Methyl Esters of Some Oils: Comparison with the Relevant American Oil Chemists Society Method. J Amer Oil Chem Soc 77, 1235-1238 (2000). Recuperado de link.springer.com.
- Knothe, G. (2007). Arthur von Hübl and the Iodine Value. Inform, February 2007, Vol. 18(2), pp.136-8. Recuperado de lipidlibrary.aocs.org.
