Energía de activación: concepto, fórmula, unidades, cálculo, ejemplos
¿Qué es la energía de activación?
La energía de activación (Ea) se define como la mínima energía necesaria para que una reacción química se pueda llevar a cabo. En otras palabras, es la barrera energética que se debe superar para que los reactivos puedan convertirse en productos.
La energía de activación se puede ver en acción en la vida diaria. En efecto, todos sabemos que, al abrir la llave de paso del gas en la cocina, este no se quema inmediatamente al entrar en contacto con el aire.
Para que la reacción de combustión comience, se necesita aportar una chispa o el fuego de una cerilla encendida. Esta chispa o este fuego, representan la energía de activación de la reacción de combustión.
¿Por qué se requiere de una energía de activación?
Para entender la razón por la cual las reacciones necesitan de una energía mínima para ocurrir, es importante entender, en primer lugar, cómo ocurren. Para que dos átomos o moléculas puedan reaccionar, primero deben colisionar. Además, deben hacerlo con la orientación adecuada para que se puedan formar los enlaces químicos nuevos y se puedan romper los viejos.
Sin embargo, aun si las dos moléculas se dirigen la una hacia la otra con la orientación perfecta, esto no asegura que se dé una colisión efectiva, debido a la repulsión entre los electrones de la superficie de las moléculas.
Por esta razón, es necesario que, además de una correcta orientación, las moléculas también viajen con cierta velocidad o con cierta energía cinética mínima que asegure que la colisión sea lo suficientemente fuerte como para contrarrestar la repulsión de los electrones.
Esta energía cinética mínima necesaria a nivel microscópico, es la que se traduce en la energía de activación de la reacción.
¿Cómo se ve en un diagrama de energía?
Un diagrama de energía es una representación gráfica que muestra cómo varía la energía de los reactivos a medida que se van transformando en productos. En estos diagramas, como el que se presenta a continuación, es fácil ver e interpretar la energía de activación.
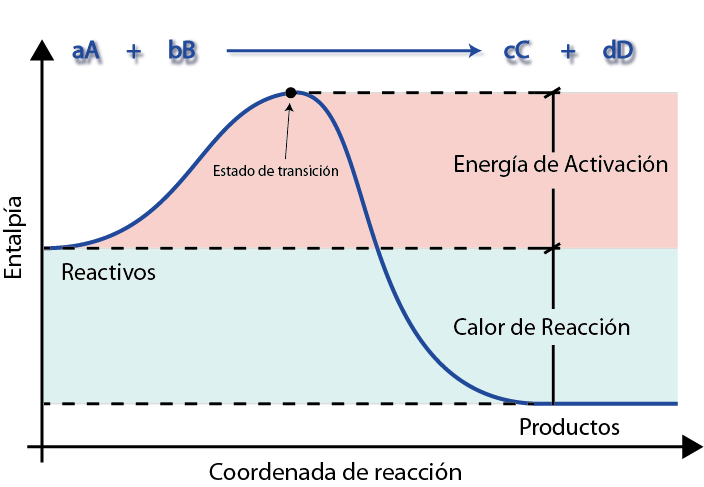
En este gráfico la línea azul muestra la energía a medida que avanza la reacción. Aquí se puede ver que, para convertirse en los productos, los reactivos primero deben superar una colina para llegar hasta el estado de transición. De lo contrario, se devolverán a su estado inicial.
La altura de esta colina es justamente la energía de activación. Si se logra superar, el resto del camino es cuesta abajo, y los reactivos terminan de convertirse rápidamente en los productos.
Unidades de la energía de activación
La energía de activación es una magnitud intensiva que se expresa en unidades de energía sobre masa o sobre moles. Como existen diferentes unidades de energía y diferentes unidades de masa, la energía de activación se puede expresar en varias unidades diferentes. Sin embargo, las utilizadas con mayor frecuencia en química son:

Cuál unidad se utiliza depende de los datos a partir de los cuales se calcula, o del uso que se le dará en otros cálculos.
Fórmula de la energía de activación
La energía de activación está relacionada con la velocidad de reacción. De hecho, mientras mayor energía de activación, menor es la velocidad. Esta relación se expresa matemáticamente por medio de la ecuación de Arrhenius, la cual relaciona la constante de velocidad de una reacción con la temperatura.
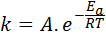
En esta ecuación, k es la constante de velocidad de la reacción, Ea es la energía de activación, R es la constante de los gases ideales, T es la temperatura absoluta y A se denomina factor pre-exponencial de Arrhenius, también llamado factor de colisión.
Esta ecuación se puede reordenar para dar:
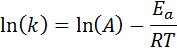
Si se conoce el valor de A para la reacción, entonces la energía de activación se puede obtener despejando la ecuación anterior. Sin embargo, esta no es la forma como se suele determinar la energía de activación de una reacción. Normalmente se determina la constante de velocidad a dos o más temperaturas, lo que hace innecesario conocer A.
¿Cómo se calcula la energía de activación?
La energía de activación se determina a partir de los valores de la constante de velocidad a diferentes temperaturas. Se necesitan por lo menos dos valores de k medidos a diferentes valores de T para poder calcular la energía de activación sin necesidad de conocer A, lo cual suele ser el caso.
Dependiendo de cuántos valores de k se tienen, se puede calcular Ea de dos maneras:
1. Cuando se tiene k a dos temperaturas
En estos casos, es más fácil partir de la primera forma de la ecuación de Arrhenius. Si llamamos k1 a la constante de velocidad a la temperatura T1 y k2 a la constante de velocidad a la temperatura T2, entonces podemos escribir la ecuación de Arrhenius dos veces:
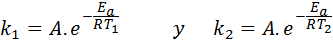
Ahora, podemos dividir cualquiera de las dos ecuaciones entre la otra para cancelar a A:
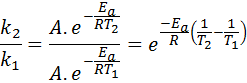
Luego, tomando logaritmo neperiano en ambos lados y resolviendo para Ea, se obtiene:
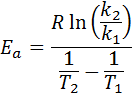
2. Cuando se tiene k a más de dos temperaturas
En los casos en los que se tiene varias determinaciones de la constante de velocidad a varias temperaturas, es preferible hallar la energía de activación gráficamente o por medio de regresión lineal. Esto se basa en la ecuación en forma logarítmica, la cual tiene la forma de una recta:
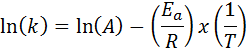
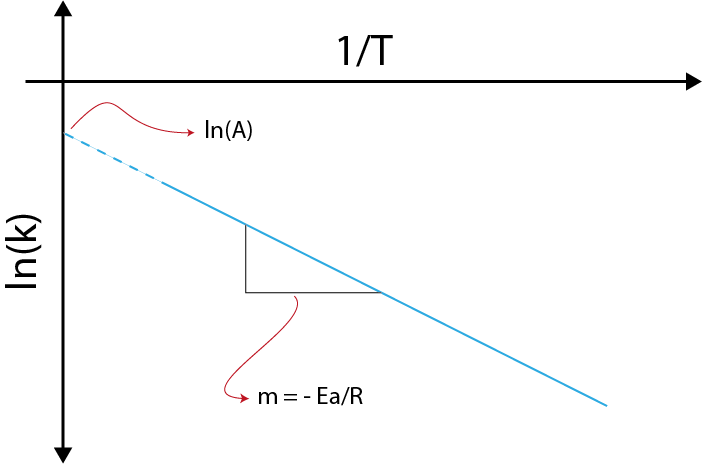
Si hacemos una gráfica de ln(k) versus (1/T), obtendremos una línea recta que corta al eje y en ln(A) y cuya pendiente es igual a –(Ea/R). De allí se obtiene la energía de activación.
Ejemplos de cálculo de energías de activación
Ejemplo 1
La constante de velocidad de una reacción de primer orden se determinó a dos temperaturas diferentes. A 298 K tuvo un valor de 0.058 s-1, mientras que a 350 K el valor aumentó hasta 0,425 s-1. Determinar la energía de activación de esta reacción en J/mol.
- Solución: Como se tiene la constante a dos temperaturas, se puede utilizar directamente la fórmula de energía de activación mostrada anteriormente. Como se pide la energía en unidades de J/mol, entonces debemos utilizar la constante de los gases en dichas unidades:
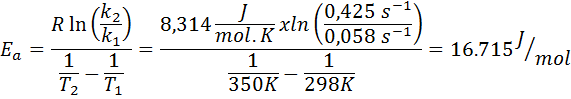
Ejemplo 2
Se mide la constante de velocidad para una reacción química de segundo orden a diferentes temperaturas. Los valores se presentan en la siguiente tabla. Determine la energía de activación en kcal/mol.

- Solución: Como en este caso se tienen varias temperaturas, es preferible determinar la energía de activación gráficamente. Para ello, se hace una gráfica de ln(k) vs 1/T, la cual se presenta a continuación.
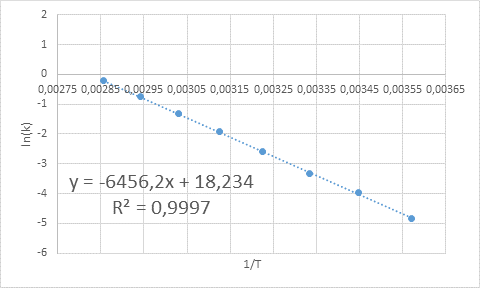
De la ecuación de la recta que se muestra en la gráfica se obtiene la pendiente, que es -6456,2. Como la pendiente (m) es igual a – Ea/R, entonces:
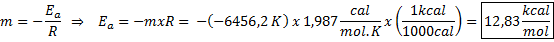
Es decir, la energía de activación de esta reacción es de 12,83 kcal/mol.
