Transaminación: concepto, mecanismo, función y ejemplos
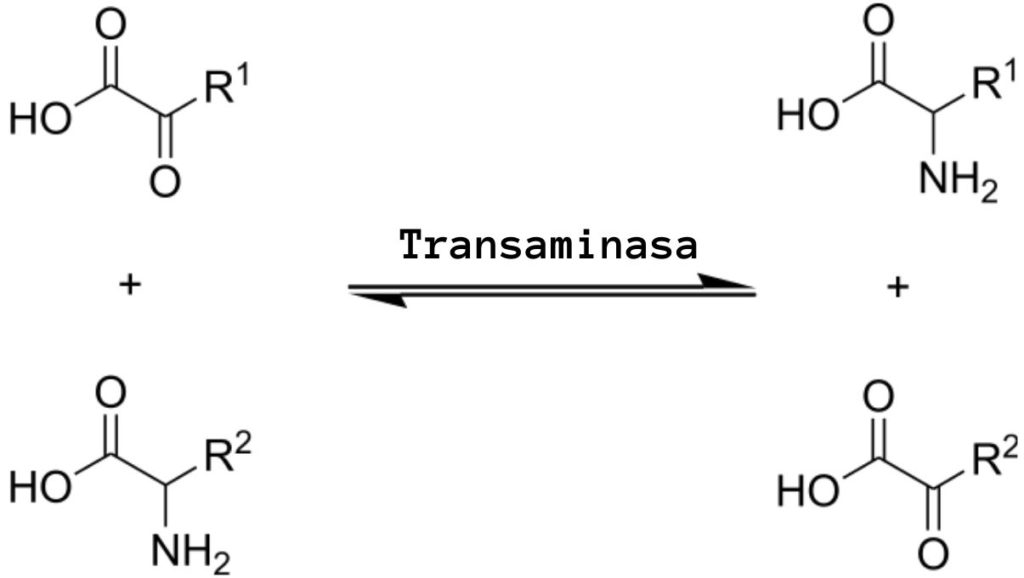
¿Qué es la transaminación?
La transaminación es un tipo de reacción química que funciona en la “redistribución” de los grupos amino entre aminoácidos, puesto que envuelve procesos reversibles de aminación (adición de un grupo amino) y desaminación (eliminación de un grupo amino), que son catalizados por enzimas específicas conocidas como transaminasas o aminotransferasas.
La reacción general de transaminación implica el intercambio entre un aminoácido y un α-cetoácido cualquiera, donde el intercambio de un grupo amino rinde la versión cetoácida del primer aminoácido sustrato y la versión aminoacídica del primer α-cetoácido sustrato.
El grupo amino que es intercambiado usualmente es el amino “alfa”, es decir, aquel que participa en la formación de los enlaces peptídicos y que define la estructura de los aminoácidos, aunque también pueden ocurrir reacciones que involucran otros grupos amino presentes en posiciones diferentes.
Con excepción de la lisina, la treonina, la prolina y la hidroxiprolina, todos los aminoácidos participan en reacciones de transaminación, aunque para la histidina, la serina, la metionina y la fenilalanina se han descrito transaminasas, pero sus rutas metabólicas no implican este tipo de reacciones.
Las reacciones de transaminación entre aminoácidos y α-cetoácidos fueron descubiertas en 1937 por Braunstein y Kritzmann, y desde entonces han sido objeto de intensos estudios, pues ocurren en muchos tejidos de organismos diferentes y con distintos propósitos.
En los seres humanos, por ejemplo, las transaminasas están ampliamente distribuidas en los tejidos corporales y son particularmente activas en el tejido muscular cardiaco, en el hígado, en el tejido muscular esquelético y en los riñones.
Mecanismo de reacción
Las reacciones de transaminación implican más o menos el mismo mecanismo. Como se comentó anteriormente, estas reacciones ocurren como un intercambio reversible de un grupo amino entre un aminoácido y un α-cetoácido (desaminado), produciendo el α-cetoácido del aminoácido donador y el aminoácido del α-cetoácido receptor.
Estas reacciones dependen de un compuesto conocido como piridoxal fosfato, un derivado de la vitamina B6 que participa como un transportador de grupos amino y que se une a las enzimas transaminasas por medio de la formación de una base de Schiff entre el grupo aldehído de esta molécula y el ε-amino de un residuo de lisina en el sitio activo de la enzima.
La unión entre el piridoxal fosfato y el residuo de lisina en el sitio activo no es covalente, sino que se da a través de la interacción electrostática entre la carga positiva del nitrógeno en la lisina y la carga negativa en el grupo fosfato del piridoxal.
En el transcurso de la reacción, el aminoácido que funciona como sustrato desplaza el grupo ε-amino del residuo de lisina en el sitio activo que participa en la base de Schiff con el piridoxal.
Mientras tanto, un par de electrones del carbono alfa del aminoácido son removidos y transferidos hacia el anillo de piridina que compone al piridoxal fosfato (con carga positiva) y luego son “entregados” al α-cetoácido que funciona como segundo sustrato.
De esta manera, el piridoxal fosfato no solo participa en la transferencia o el transporte de los grupos amino entre los aminoácidos y los α-cetoácidos que son sustrato de las transaminasas, sino que también actúa como “sumidero” de electrones, facilitando la disociación del hidrógeno alfa del aminoácido.
En resumen, el primer sustrato, un aminoácido, transfiere su grupo amino al piridoxal fosfato, desde donde se transfiere subsecuentemente hacia el segundo sustrato, un α-cetoácido, formando, en el ínterin, un compuesto intermediario conocido como piridoxamina fosfato.
Función de la transaminación
Las enzimas transaminasas se encuentran, generalmente, en el citosol y las mitocondrias y funcionan en la integración de distintas rutas metabólicas.
La glutamato deshidrogenasa en su reacción inversa, por ejemplo, puede convertir glutamato en amonio, NADH (o NADPH) y α-cetoglutarato, el cual puede ingresar el ciclo de los ácidos tricarboxílicos y funcionar en la producción de energía.
Esta enzima, que está en la matriz mitocondrial, representa un punto de ramificación que asocia a los aminoácidos con el metabolismo energético, de modo que cuando una célula carece de suficiente energía en forma de carbohidratos o grasas para funcionar, puede, alternativamente, utilizar algunos aminoácidos para el mismo fin.
La formación de la enzima (glutamato deshidrogenasa) durante el desarrollo del cerebro es fundamental para el control de la desintoxicación de amonio, ya que ha sido demostrado que algunos casos de retardo mental tienen que ver con una baja actividad de esta, lo que conlleva a la acumulación de amonio, que es perjudicial para la salud cerebral.
En algunas células hepáticas las reacciones de transaminación también pueden ser empleadas para la síntesis de glucosa por gluconeogénesis.
La glutamina es convertida en glutamato y amonio por la enzima glutaminasa. Luego, el glutamato es convertido en α-cetoglutarato, que ingresa al ciclo de Krebs y después a la gluconeogénesis. Este último paso ocurre gracias a que el malato, uno de los productos de la ruta, es transportado hacia el exterior de la mitocondria por medio de una lanzadera.
Dicha lanzadera deja al α-cetoglutarato a merced de la enzima málica, que lo convierte en piruvato. Dos moléculas de piruvato pueden ser convertidas, entonces, en una molécula de glucosa a través de la gluconeogénesis.
Ejemplos
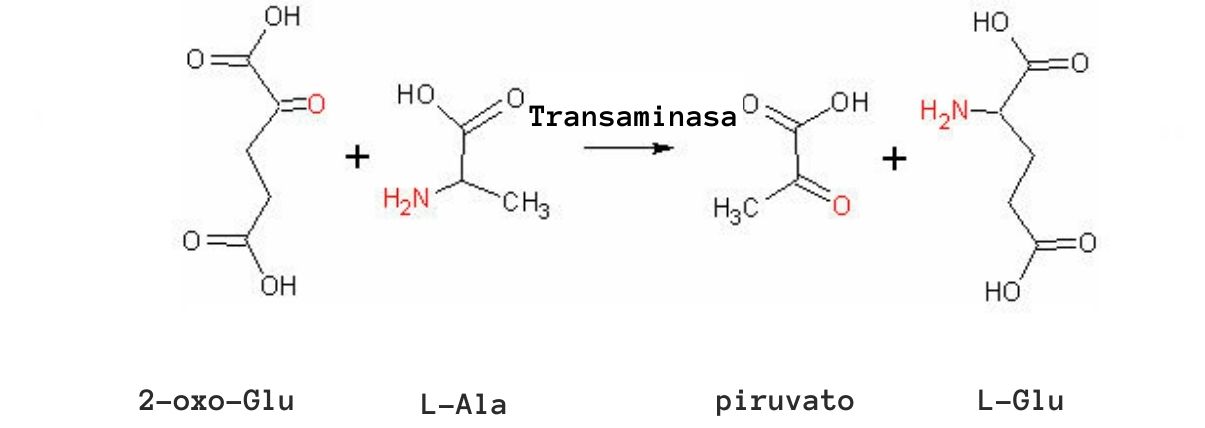
Las reacciones de transaminación más comunes se relacionan con los aminoácidos alanina, ácido glutámico y ácido aspártico.
Algunas enzimas aminotransferasas pueden, además del piridoxal fosfato, emplear al piruvato como “coenzima”, como es el caso de la glutamato-piruvato transaminasa, que cataliza la siguiente reacción:
glutamato + piruvato ↔ alanina + α-Cetoglutarato
Las células musculares dependen de esta reacción para producir alanina a partir de piruvato y para obtener energía a través del ciclo de Krebs por medio del α-cetoglutarato. En dichas células la utilización de la alanina como fuente de energía depende de la eliminación de los grupos amino como iones de amonio en el hígado, a través del ciclo de la urea.
Otra reacción de transaminación muy importante en diferentes especies es la catalizada por la enzima aspartato aminotransferasa:
L-Aspartato + α-Cetoglutarato ↔ Oxalacetato + L-Glutamato
Finalmente, pero no menos importante, la reacción de transaminación del ácido γ-aminobutírico (GABA), un aminoácido no proteico esencial para el sistema nervioso central que funciona como neurotransmisor inhibitorio. La reacción es catalizada por un ácido γ-aminobutírico transaminasa y es más o menos como sigue:
α-Cetoglutarato + ácido 4-aminobutanoico ↔ Glutamato + Semialdehído succínico
El semialdehído succínico es convertido en ácido succínico mediante una reacción de oxidación y este último puede ingresar al ciclo de Krebs para la producción de energía.
