Metabisulfito de sodio (Na2S2O5): estructura, propiedades, usos, riesgos
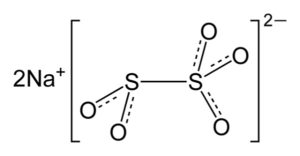
El metabisulfito de sodio es un compuesto inorgánico formado por dos iones sodio Na+ y un ion metabisulfito o disulfito S2O52-. Su fórmula química es Na2S2O5. Es un sólido blanco cristalino. Se usa como antioxidante y agente antimicrobiano en una variedad de productos farmacéuticos y funciona como conservante en muchas preparaciones alimenticias.
El Na2S2O5 sirve para tratar la harina para hacer galletas y dulces de pastelería pues ayuda a romper las moléculas de proteína y hacer que la masa sea más fácil de moldear y no se encoja al cortarla en piezas más pequeñas.

Se emplea en muchos alimentos procesados para evitar que sean atacados por hongos y bacterias. Entre estos alimentos se encuentran los quesos, los jugos de frutas, las salsas, las margarinas, etc.
Sin embargo, dado que se han notado algunos efectos negativos sobre la salud de las personas, los organismos autorizados controlan la cantidad máxima de metabisulfito de sodio Na2S2O5 que deben contener estos alimentos.
Las otras aplicaciones del Na2S2O5 se basan por lo general en sus propiedades reductoras (lo contrario de oxidante), como por ejemplo para disminuir la cantidad de cloro en aguas tratadas, como blanqueador de lana, en fórmulas cosméticas, entre otros usos.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos en alimentos
- 6 Otros usos
- 7 Riesgos
- 8 Referencias
El metabisulfito de sodio está formado por dos iones sodio Na+ y un ion bisulfito S2O52-. Este último posee dos átomos de azufre unidos entre sí y cinco átomos de oxígeno repartidos entre estos.
-Metabisulfito de sodio
-Pirosulfito de sodio
-Disulfito de sodio
-Disulfito de disodio
Sólido incoloro, blanco o amarillento cristalino. Cristales hexagonales.
190,11 g/mol
A temperaturas mayores de 150 °C se descompone.
1,4 a 25 °C/4 °C
Muy soluble en agua: 66,7 g/100 g de agua.
Sus soluciones acuosas son ácidas. Una solución al 10% tiene un pH de 4,0-5,5.
Al disolverse en agua resulta un ácido corrosivo. Tiene propiedades reductoras y antioxidantes.
Si se expone al aire se oxida lentamente a sulfato de sodio Na2SO4, perdiendo también parte de su contenido de SO2.
Reacciona con el agua para dar bisulfito de sodio NaHSO3, dióxido de azufre SO2 y sulfito de sodio Na2SO3.
Posee un ligero olor a azufre. No es combustible, pero sometido al calor puede generar gases tóxicos.
El metabisulfito de sodio se puede obtener haciendo pasar un exceso del gas dióxido de azufre SO2 por una solución de carbonato de sodio Na2CO3.
El Na2S2O5 es un antioxidante. Sirve como conservante e inhibidor de ciertos microorganismos. Su efecto antimicrobiano es óptimo por debajo de pH = 4, como en los jugos de frutas.
Permite prevenir el deterioro y hacer más lento el ennegrecimiento de ciertos alimentos. Se ha empleado por ejemplo para evitar el oscurecimiento de las batatas.
Se usa durante la cosecha de camarones marinos para prevenir la formación de manchas negras. Los camarones se sumergen en una solución de metabisulfito en hielo.

Es un antioxidante efectivo y mejora la retención de ácido ascórbico (vitamina C) en frutas desecadas y jugos. En estos inhibe ciertos tipos de bacterias, hongos y levaduras.
Se ha utilizado en Sudáfrica para controlar el deterioro e inhibir el oscurecimiento de la fruta de lichi. Sin embargo, parece ser que cambia ligeramente el sabor de dicha fruta.
Otros alimentos en los que se usa son el queso, diversas bebidas, margarina, salsas, dulces y pescado.
En las uvas luego de la cosecha se usa como fungicida, pues ciertos hongos pueden crecer sobre esta fruta. Actúa luego sobre ciertos microorganismos específicos, lo que lo hace útil en la industria del vino pues permite controlar su fermentación.
El metabisulfito residual es efectivo luego de la fermentación del vino para evitar el crecimiento de levaduras tolerantes al alcohol.
También se ha utilizado en el jugo de manzana y en la sidra para controlar ciertos microorganismos patógenos como la Escherichia coli.
Sirve para acondicionar la masa de algunos alimentos horneados. Actúa como agente reductor en la manufactura de galletas, especialmente aquellas bajas en grasa y bajas en azúcar, y en dulces de pastelería.
El metabisulfito reacciona con los enlaces de azufre S–S de las proteínas contenidas en la harina de la masa con que se preparan las galletas y dulces, ablandándola, haciendo que sea más extensible y menos elástica.
Uno de los objetivos es evitar que la masa se encoja, ya sea antes o durante el horneado. Sin embargo, su uso en la masa de galletas no es siempre aceptado y se prefiere utilizar otras alternativas.

Sirve también para blanquear almidones comestibles y para ablandar los granos de maíz durante el proceso de molienda húmeda.
La Administración de Alimentos y Medicinas de los Estados Unidos, o FDA (por sus siglas del inglés Food and Drug Administration) etiquetó al metabisulfito de sodio Na2S2O5 como una sustancia “considerada generalmente segura”.
Sin embargo, ha sido reconocido por dicho organismo como un compuesto antitiamina o antivitamina B1.
Por lo tanto no debe usarse en carnes, ni en alimentos que sean fuente de vitamina B1. Tampoco debe utilizarse en frutas o vegetales que sean vendidos crudos a los consumidores o que se presenten como frescos.
Según algunas fuentes consultadas si se utiliza en concentraciones superiores a 10 mg/Kg de alimento debe reportarse en la etiqueta de este.
Otras aplicaciones del Na2S2O5 se muestran a continuación.
-Como agente reductor en fórmulas cosméticas y como antioxidante por ejemplo en productos para el cuidado del cabello.
-Como antioxidante en preparaciones farmacéuticas, como jarabes o fluidos inyectables. Se usa en preparaciones ácidas. Posee cierta actividad antimicrobiana, especialmente a pH ácido.
-Como reactivo de laboratorio, por ejemplo para preservar la histamina cuando se realiza su análisis.
-Como agente reductor en el revelado de fotografías.
-Para reducir el cloro en el agua de procesos industriales y en tratamiento de aguas residuales.
-En la industria textil: como blanqueador de lana, como agente anticloro luego del blanqueo del nylon, para reducir algunos colorantes y para solubilizar otros.
-Para producir dióxido de azufre SO2 en el sitio de uso. Por ejemplo en los silos de hierba fresca, el SO2 producido por el metabisulfito de sodio desarrolla acidez de forma rápida y permite la conservación del material, pues la fermentación tomaría demasiado tiempo.

-Si se inhala el Na2S2O5 sólido resulta tóxico. El contacto directo irrita fuertemente la piel, las membranas mucosas y los tejidos. Es irritante de los ojos y del sistema respiratorio.
-Si se ingiere directamente puede producir dolores abdominales, diarrea, nausea y vómitos.
-Es corrosivo.
-Se dice que algunos asmáticos son peligrosamente sensibles a minúsculas cantidades de metabisulfito en las comidas.
-Es dañino para los organismos acuáticos.
- Cauvain, S.P. (2017). Raw materials. In Baking Problems Solved (Second Edition). Recuperado de sciencedirect.com.
- U.S. National Library of Medicine. (2019). Sodium metabisulfite. National Center for Biotechnology Information. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Sivakumar, D. and Korsten, L. (2011). Litchi (Litchi chinensis Sonn.). In Postharvest Biology and Technology of Tropical and Subtropical Fruits: Cocona to Mango. Recuperado de sciencedirect.com.
- Danyluk, M.D. et al. (2012). Microbial decontamination of juices. In Microbial Decontamination in the Food Industry. Recuperado de sciencedirect.com.
- Wieser, H. (2012). The use of redox agents in breadmaking. In Breadmaking (Second Edition). Recuperado de sciencedirect.com.
- Ercan, S. et al. (2015). Induction of omega 6 inflammatory pathway by sodium metabisulfite in rat liver and its attenuation by ghrelin. Lipids in Health and Disease (2015) 14:7. Recuperado de ncbi.nlm.nih.gov.
