Carburo de calcio (CaC2): estructura, propiedades, obtención, usos
El carburo de calcio es un compuesto inorgánico formado por los elementos calcio (Ca) y carbono (C). Su fórmula química es CaC2. Es un sólido que puede ser incoloro a blanco amarillento o grisáceo, e incluso negro dependiendo de las impurezas que contenga.
Una de sus reacciones químicas más importantes del CaC2 es la que ocurre con el agua H2O, en la cual forma acetileno HC≡CH. Por ello se utiliza para obtener el acetileno de manera industrial. Debido a esa misma reacción con agua se emplea para madurar frutas, en cañones falsos y en bengalas navales.

La reacción del CaC2 con agua además produce un lodo útil para preparar clínker (un componente del cemento), que produce menos dióxido de carbono (CO2) si se compara con el método tradicional de producir cemento.
Con nitrógeno (N2) el carburo de calcio forma cianamida de calcio, que se usa como fertilizante. El CaC2 también se utiliza para remover azufre de ciertas aleaciones metálicas.
Hace algún tiempo el CaC2 se utilizaba en las llamadas lámparas de carburo, pero estas ya no son muy comunes porque son peligrosas.
Índice del artículo
El carburo de calcio es un compuesto iónico y está formado por el ion calcio Ca2+ y el ion carburo o acetiluro C22-. El ion carburo está formado por dos átomos de carbono unidos por un triple enlace.
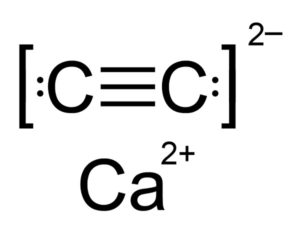
La estructura cristalina del CaC2 es derivada de la cúbica (como la del cloruro de sodio NaCl), pero como el ion C22- es alargado la estructura se distorsiona y se vuelve tetragonal.
- Carburo de calcio
- Carburo cálcico
- Acetiluro de calcio
Sólido cristalino que cuando está puro es incoloro, pero si está contaminado con otros compuestos puede ser de blanco amarillento o grisáceo a negro.

64,0992 g/mol
2160 ºC
El CaC2 hierve a 2300 ºC con descomposición. El punto de ebullición debe medirse bajo atmósfera inerte, es decir, sin oxígeno ni humedad.
2,22 g/cm3
El carburo de calcio reacciona con el agua para formar acetileno HC≡CH e hidróxido de calcio Ca(OH)2:
CaC2 + 2 H2O → HC≡CH + Ca(OH)2
El acetileno es inflamable, por lo tanto en presencia de humedad el CaC2 puede ser inflamable. Sin embargo, cuando está seco no lo es.

El carburo de calcio reacciona con nitrógeno N2 para formar cianamida de calcio CaCN2:
CaC2 + N2 → CaCN2 + C
El carburo de calcio se produce industrialmente en un horno de arco eléctrico partiendo de una mezcla de carbonato de calcio (CaCO3) y carbón (C) que se somete a una temperatura de 2000 °C. La reacción se resume así:
CaCO3 + 3 C → CaC2 + CO↑ + CO2↑
O también:
CaO + 3 C → CaC2 + CO↑
En un horno de arco eléctrico se produce un arco de electricidad entre dos electrodos de grafito, los cuales resisten las altas temperaturas que se forman. Se obtiene un carburo de calcio con 80-85% de pureza.
Industrialmente se utiliza la reacción del carburo de calcio con el agua para producir acetileno C2H2.
CaC2 + 2 H2O → HC≡CH + Ca(OH)2
Este es el uso más importante del carburo de calcio. En algunos países el acetileno es muy apreciado, pues permite producir cloruro de polivinilo, que es un tipo de plástico. Además el acetileno sirve para realizar soldaduras a altas temperaturas.

Los restos obtenidos de la obtención de acetileno partiendo de CaC2 (también llamados “lodos de carburo de calcio” o “residuos de carburo de calcio”) sirven para ser utilizados en la obtención de clínker o concreto.
El lodo de carburo de calcio posee un alto contenido de hidróxido de calcio (Ca(OH)2) (alrededor de un 90%), algo de carbonato de calcio (CaCO3) y tiene un pH mayor que 12.

Por estas razones puede reaccionar con SiO2 o Al2O3 formando un producto similar al obtenido por el proceso de hidratación del cemento.
Una de las actividades humanas que produce más emisiones de CO2 es la industria de la construcción. El CO2 se genera al este desprenderse del carbonato de calcio durante la reacción para formar concreto.
Utilizando el lodo de carburo de calcio para sustituir al carbonato de calcio (CaCO3) se ha encontrado que se disminuyen las emisiones de CO2 en un 39%.
El carburo de calcio también se emplea industrialmente para obtener cianamida de calcio CaCN2.
CaC2 + N2 → CaCN2 + C
La cianamida de calcio tiene uso como fertilizante, pues con el agua del suelo se convierte en cianamida H2N=C=N, la cual proporciona nitrógeno a las plantas, un nutriente esencial para estas.
El carburo de calcio se utiliza para remover azufre de aleaciones como la de ferroníquel. Se mezcla el CaC2 con la aleación fundida a 1550 °C. El azufre (S) reacciona con el carburo de calcio y se produce sulfuro de calcio CaS y carbón C:
CaC2 + S → 2 C + CaS
La remoción de azufre se favorece si el mezclado es eficiente y el contenido de carbono en la aleación es bajo. El sulfuro de calcio CaS flota sobre la superficie de la aleación fundida de donde se decanta y se descarta.
El carburo de calcio se ha empleado en la eliminación de azufre del hierro. También como combustible en la producción del acero y como un potente desoxidante.
Se utiliza para madurar fruta. A partir de carburo de calcio con agua se genera acetileno, el cual induce la maduración de las frutas, como por ejemplo los plátanos.

El carburo de calcio se usa en cañones falsos para causar el fuerte ruido de explosión que los caracteriza. Aquí también se usa la formación de acetileno, el cual explota con una chispa dentro del artefacto.
El CaC2 se emplea para generar señales en alta mar en bengalas navales que se autoencienden.
El CaC2 se ha utilizado en las llamadas lámparas de carburo. El funcionamiento de estas consiste en hacer gotear agua sobre el carburo de calcio para formar acetileno, que se enciende y de esta forma proporciona luz.
Estas lámparas se utilizaban en minas de carbón, pero su uso fue descontinuado debido a la presencia del gas metano CH4 en dichas minas. Dicho gas es inflamable y la llama de la lámpara de carburo lo puede hacer incendiar o explotar.

Fueron muy utilizadas en minas de roca pizarra, cobre y estaño, y también en los primeros automóviles, motocicletas y bicicletas, como luces delanteras o faros.
Actualmente se han reemplazado por lámparas eléctricas o incluso lámparas LED. Sin embargo, aún se usan en países como Bolivia, en las minas de plata de Potosí.
El carburo de calcio CaC2 seco no es inflamable pero en presencia de humedad forma acetileno rápidamente, que sí lo es.
Para extinguir un incendio en presencia de CaC2 nunca se debe usar agua, espuma, dióxido de carbono o extinguidores de halógeno. Se debe usar arena o hidróxido de sodio o de calcio.
- Ropp, R.C. (2013). Group 14 (C, Si, Ge, Sn, and Pb) Alkaline Earth Compounds. Calcium Carbides. In Encyclopedia of the Alkaline Earth Compounds. Recuperado de sciencedirect.com.
- Pohanish, R. P. (2017). C. Calcium Carbide. In Sittig’s Handbook of Toxic and Hazardous Chemicals and Carcinogens (Seventh Edition). Recuperado de sciencedirect.com.
- Sun, H. et al. (2015). Properties of Chemically Combusted Calcium Carbide Residue and Its Influence on Cement Properties. Materials 2015, 8, 638-651. Recuperado de ncbi.nlm.nih.gov.
- Nie, Z. (2016). Eco-Materials and Life-Cycle Assessment. Case Study: CO2 Emission Analysis of Calcium Carbide Sludge Clinker. In Green and Sustainable Manufacturing of Advanced Material. Recuperado de sciencedirect.com.
- Crundwell, F.K. Et al. (2011). Refining Molten Ferronickel. Sulfur Removal. In Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals. Recuperado de sciencedirect.com.
- Tressler, R.E. (2001). Structural and Thermostructural Ceramics. Carbides. In Encyclopedia of Materials Science and Technology. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
