Enlace Pi: qué es, cómo se forma, características, ejemplos
¿Qué es un enlace pi?
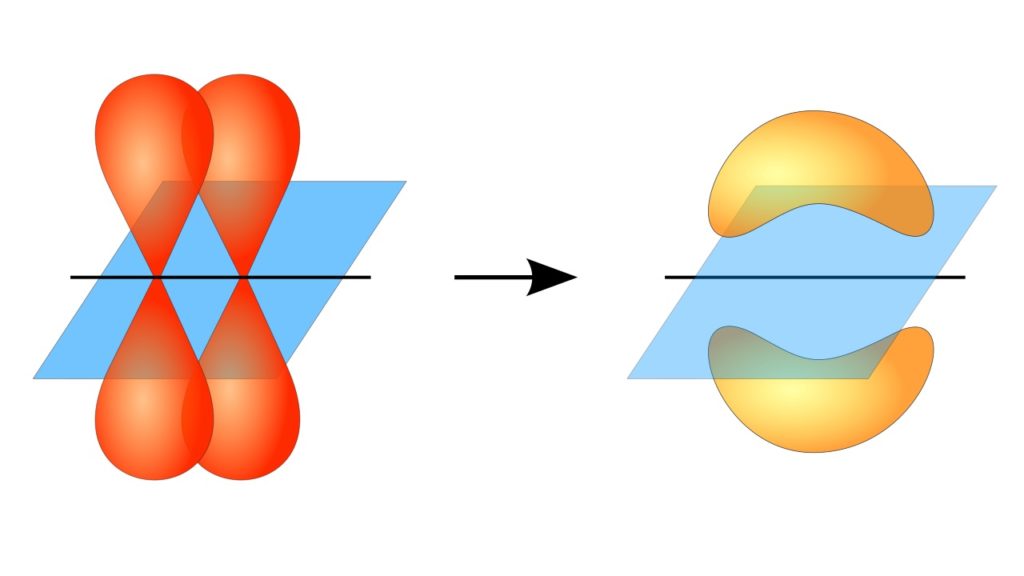
Un enlace pi (π) es un tipo de enlace covalente caracterizado por impedir el movimiento de rotación libre de los átomos y por originarse entre un par de orbitales atómicos de tipo puro, entre otras peculiaridades. Hay enlaces que pueden formarse entre átomos por sus electrones, que les permiten armar estructuras más grandes y complejas: moléculas.
Estos enlaces pueden ser de distintas variedades, pero los más comunes en este campo de estudio son los covalentes. Los enlaces covalentes, llamados también moleculares, son un tipo de enlace en donde los átomos involucrados comparten pares de electrones.
Esto puede ocurrir por la necesidad de los átomos de buscar estabilidad, formando así la mayoría de los compuestos que se conocen. En este sentido, los enlaces covalentes pueden ser sencillos, dobles o triples, dependiendo de la configuración de sus orbitales y la cantidad de pares de electrones compartidos entre los átomos involucrados.
Es por esto que existen dos tipos de enlace covalente que se forman entre átomos basándose en la orientación de sus orbitales: los enlaces sigma (σ) y los enlaces pi (π).
Es importante diferenciar ambos enlaces, pues el enlace sigma se presenta en uniones simples y el pi en uniones múltiples entre átomos (dos o más electrones son compartidos).
¿Cómo se forma el enlace pi?
Para poder describir la formación del enlace pi primero debe hablarse sobre el proceso de la hibridación, pues este interviene en algunos enlaces importantes.
La hibridación es un proceso en donde se forman orbitales electrónicos híbridos; es decir, donde orbitales de subniveles atómicos s y p pueden llegar a mezclarse. Esto origina la formación de orbitales sp, sp2 y sp3, los cuales se llaman híbridos.
En este sentido, la formación de los enlaces pi ocurre gracias al solapamiento de un par de lóbulos pertenecientes a un orbital atómico sobre otro par de lóbulos que se encuentran en un orbital que forma parte de otro átomo.
Este traslape de orbitales ocurre de manera lateral, por lo cual la distribución electrónica está concentrada mayormente por encima y por debajo del plano que forman los núcleos atómicos enlazados, y ocasiona que los enlaces pi sean más débiles que los enlaces sigma.
Al hablar de la simetría orbital de este tipo de unión, debe mencionarse que es igual a la de los orbitales tipo p siempre y cuando se observe a través del eje formado por el enlace. Además, estas uniones están en su gran mayoría constituidas por orbitales p.
Formación de enlaces pi en distintas especies químicas
Como los enlaces pi siempre están acompañados por uno o dos enlaces más (uno sigma u otro pi y uno sigma), es relevante saber que el enlace doble que se forma entre dos átomos de carbono (constituido por un enlace sigma y uno pi) posee menor energía de enlace que la correspondiente a dos veces el enlace sigma entre ambos.
Esto se explica mediante la estabilidad del enlace sigma, la cual es mayor que la del enlace pi porque el traslape de orbitales atómicos en este último ocurre de manera paralela en las regiones arriba y debajo de los lóbulos, acumulando la distribución electrónica en forma más alejada de los núcleos atómicos.
A pesar de esto, cuando se combinan enlaces pi y sigma se forma un enlace múltiple más fuerte que el enlace simple por sí mismo, lo cual se puede verificar mediante la observación de las longitudes de enlace entre diversos átomos con enlaces simples y múltiples.
Existen algunas especies químicas que son estudiadas por su comportamiento excepcional, tales como los compuestos de coordinación con elementos metálicos, en los cuales los átomos centrales se encuentran unidos solamente mediante enlaces pi.
Características del enlace pi
No permite el movimiento de rotación libre de los átomos
Las características que distinguen a los enlaces pi de otras clases de interacciones entre especies atómicas se describen seguidamente, comenzando por el hecho de que esta unión no permite el movimiento de rotación libre de los átomos, tales como los de carbono. Por esta razón, si existe rotación de los átomos se produce la ruptura del enlace.
Solapamiento entre los orbitales mediante dos regiones paralelas
Asimismo, en estos enlaces el solapamiento entre los orbitales sucede mediante dos regiones paralelas, logrando que posean una mayor difusión que los enlaces sigma y que, por esta razón, sean más débiles.
Entre un par de orbitales atómicos puros
Por otro lado, como se mencionó anteriormente, el enlace pi siempre se genera entre un par de orbitales atómicos puros; esto significa se genera entre orbitales que no han sufrido procesos de hibridación, en los cuales se concentra la densidad de los electrones mayoritariamente por encima y por debajo del plano formado por la unión covalente.
En este sentido, entre un par de átomos se puede presentar más de un enlace pi, siempre estando acompañado de un enlace sigma (en los enlaces dobles).
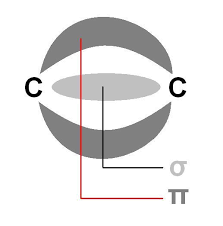
De manera similar, se puede dar un enlace triple entre dos átomos adyacentes, el cual está formado por dos enlaces pi en posiciones que forman planos perpendiculares entre sí y un enlace sigma entre ambos átomos.
Ejemplos de enlaces pi
Molécula de etileno
Como se dijo previamente, las moléculas constituidas por átomos unidos mediante uno o más enlaces pi siempre poseen enlaces múltiples; es decir, dobles o triples.
Un ejemplo de esto es la molécula de etileno (H2C=CH2), que está constituida por una unión doble; es decir, un enlace pi y uno sigma entre sus átomos de carbono, además de los enlaces sigma entre los carbonos e hidrógenos.
Molécula de acetileno
Por su parte, la molécula de acetileno (H–C≡C–H) posee un enlace triple entre sus átomos de carbono; es decir, dos enlaces pi formando planos perpendiculares y un enlace sigma, además de sus correspondientes enlaces sigma carbono-hidrógeno.
Benceno y derivados
También se presentan enlaces pi entre moléculas cíclicas, tales como el benceno (C6H6) y sus derivados, cuya disposición resulta en un efecto llamado resonancia, que permite que la densidad electrónica pueda migrar entre átomos y otorgarle, entre otras cosas, mayor estabilidad al compuesto.
Dicarbono
Para ejemplificar las excepciones mencionadas previamente se presentan los casos de la molécula de dicarbono (C=C, en la que ambos átomos poseen un par de electrones apareados) y el compuesto de coordinación llamado hexacarbonildihierro (representado como Fe2(CO)6, el cual está formado únicamente por enlaces pi entre sus átomos).
