Ejemplos de soluciones hipertónicas
Solución hipertónica: definición, componentes, preparación, ejemplos
A muchos les sorprenderá saber que la forma en la que las plantas absorben agua por sus raíces y la forma en que se arrugan los dedos de las manos al bañarse en agua de mar, están muy relacionadas.
Ambas cosas ocurren gracias a la existencia de una membrana que funciona como un filtro, y de una solución hipertónica que literalmente succiona agua a través de la misma. Pero, ¿qué es una solución hipertónica?
En el presente artículo, se dará respuesta a esta pregunta, y también se presentarán las características más relevantes de las soluciones hipertónicas, para qué sirven, cómo se distinguen de otros tipos de soluciones y algunos ejemplos de las mismas.
¿Qué es una solución hipertónica?
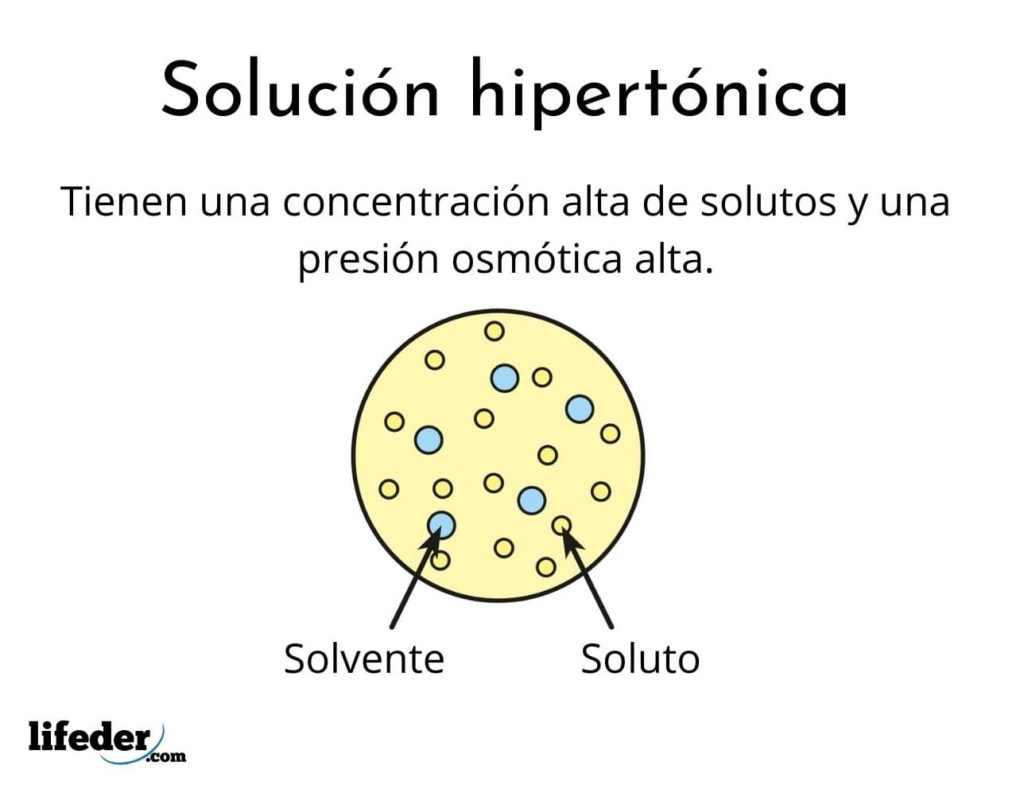
Una solución hipertónica es aquella que contiene una concentración total de solutos osmolarmente activos mayor que la de otra solución de referencia. Osmolarmente activos significa que los solutos no pueden atravesar un tipo especial de membrana (parecida a una tela) que actúa como un colador o filtro, es decir, deja pasar el agua, y no a las partículas de soluto.
Esta concentración alta de solutos hace que las soluciones hipertónicas tengan una presión osmótica alta. Esta presión es la que prácticamente succiona al agua a través de la membrana, a lo que se le llama ósmosis.
La palabra hipertónica viene del prefijo griego hiper-, que significa “sobre, o por encima de” y “tonos”, que significa tensión, o presión, así que hipertónica significa, literalmente, “que tiene una mayor presión o tensión”.
Es importante tener en cuenta que, en biología y en medicina, siempre que se habla de solución hipertónica, se refiere a una solución que es más concentrada que la solución que contiene la sangre, a la cual se le llama plasma sanguíneo.
Características de las soluciones hipertónicas
Las soluciones hipertónicas tienen algunas características básicas:
Están formadas por un solvente y por lo menos un soluto
No cualquier solución puede ser hipertónica, incluso así sea muy concentrada. El soluto debe ser incapaz de atravesar la membrana, mientras que el agua debe poder pasarla sin problema, de lo contrario, no se genera la presión osmótica.
Tienen concentraciones altas de solutos
Esto es lo que las convierte en soluciones hipertónicas. Como se mencionó hace un momento, las soluciones hipertónicas son más concentradas que la sangre.
Pueden tener composiciones distintas
Una solución hipertónica puede contener un solo soluto como la sal, o puede contener una mezcla de solutos como sales y azúcares, por ejemplo.
Los solutos pueden ser iónicos, neutros, o ambos
Las sales contienen iones con cargas eléctricas que no los dejan atravesar la membrana, así sean pequeños. Otros solutos no tienen iones, pero son grandes y gordos y no caben por los huecos.
Tienen una presión osmótica alta
Como se mencionó anteriormente, las soluciones hipertónicas tienen una presión osmótica mayor que la de la sangre.
Pueden deshidratar a las células
Las soluciones hipertónicas extraen el agua de las células dejándolas como pasas. Por eso es que se nos arrugan los dedos de las manos y los pies cuando nos bañamos en la playa.
¿Para qué sirven las soluciones hipertónicas?
Las soluciones hipertónicas tienen muchos usos en la vida diaria, y también en la medicina. Algunos de los usos más comunes son:
Se utilizan para conservar alimentos
- Ejemplo: los melocotones en almíbar no se pudren porque el almíbar tiene mucha azúcar disuelta y es una solución muy hipertónica. Al deshidratar células, las soluciones hipertónicas no permiten que crezcan hongos y bacterias en la comida, porque se mueren de sed. Esto permite que los alimentos duren más.
Sirven para reducir la inflamación
- Ejemplo: cuando alguien tiene un accidente y se golpea en la cabeza, muchas veces se produce una inflamación en el cerebro. Para curar al paciente, los médicos le inyectan una solución de sal en agua al 7,5%. Esta solución prácticamente succiona el agua, reduciendo la inflamación en el cerebro.
Sirven para reponer electrolitos.
- Ejemplo: el sodio es un electrolito que necesitamos para vivir, y cuando un paciente tiene poco sodio en la sangre, se le inyecta una solución salina al 7,5% para reponer el sodio que se perdió.
Se usan para la alimentación parenteral
- Ejemplo: cuando las personas no pueden comer por la boca ni por medio de un tubo, se alimentan inyectándoles por las venas una solución hipertónica que contiene un tipo de azúcar que se llama glucosa.
Diferencias con soluciones hipotónicas e isotónicas
Así como existen soluciones hipertónicas, también existen soluciones hipotónicas e isotónicas. La diferencia entre estas últimas y las soluciones hipertónicas, es su concentración. Las soluciones hipotónicas son aquellas que son menos concentradas que la sangre, y las isotónicas tienen la misma concentración que la sangre.
Por ejemplo, el agua pura, como no tiene nada de soluto, es hipotónica, mientras que el agua de coco tiene sales y azúcares con una concentración casi igual a la de la sangre, así que es isotónica.
Además de diferenciarse por su concentración, las soluciones hiper, hipo e isotónicas se diferencian en la forma como afectan a las células.
La siguiente imagen muestra el efecto de los distintos tipos de soluciones sobre los glóbulos rojos (las pequeñas células que hacen que la sangre sea roja).
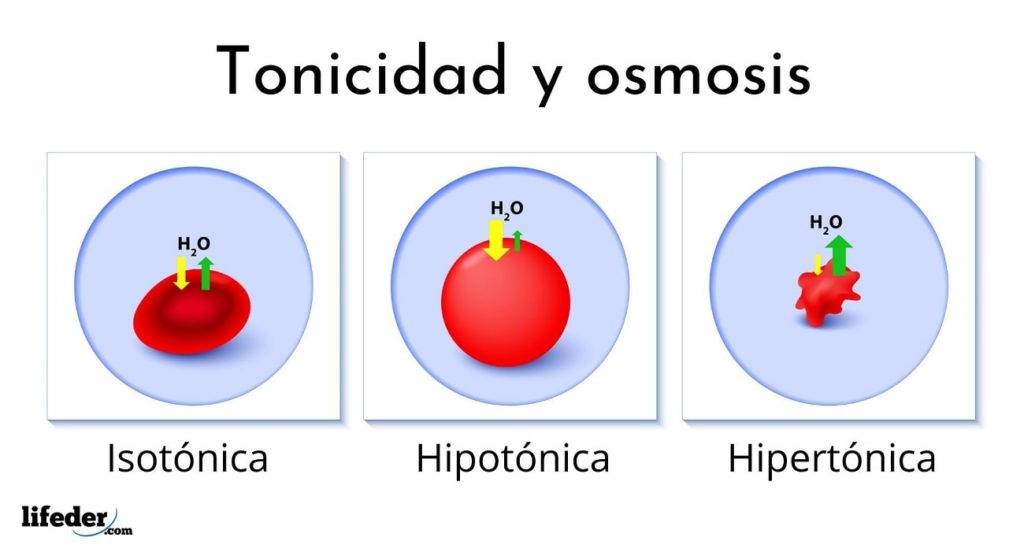
Si los glóbulos rojos se introducen en una solución hipertónica, esta les extrae el agua, deshidratándolos y dejándolos arrugados como una pasa.
En cambio, si se introducen en una solución hipotónica, los glóbulos rojos absorben agua y se hinchan, pudiendo incluso reventar como un globo que se infla demasiado. Finalmente, si se introducen en una solución isotónica, el agua dentro y fuera de los glóbulos rojos estará en equilibrio así que no pasa nada.
Ejemplos de soluciones hipertónicas
Almíbar de azúcar

El almíbar en el que se conservan los melocotones y otras frutas contiene concentraciones muy altas de azúcar, por lo que es una solución hipertónica.
La salmuera
La salmuera es una solución de agua y sal con concentraciones muy altas de entre 3,5% y 25%, lo que puede llegar a ser casi 30 veces más concentrada que la sangre (o sea que es muy hipertónica).
El vinagre
Un vinagre común es una solución hipertónica, ya que tiene una concentración de entre el 3% y el 5% de ácido acético. Las reducciones de vinagre balsámico son incluso más concentradas.
La misma sangre de nuestras venas, luego de sudar mucho.
Al hacer mucho ejercicio y sudar, el cuerpo elimina agua y sales, pero elimina más agua que sales (el sudor es hipotónico) por lo que la sangre se concentra y se torna hipertónica.
Agua de mar
El agua de mar contiene muchas sales disueltas, con una concentración total de cerca del 3,5%, lo que la hace hipertónica. Por eso es que el agua de mar arruga nuestros dedos.
Bebidas azucaradas
Las bebidas de cola y otras bebidas azucaradas pueden contener hasta el 10% de azúcar, así como sales y otros solutos con concentraciones mayores que la sangre.
Solución de dextrosa al 5% y cloruro de sodio al 0,45% (D5 ½ NS)
Este es un ejemplo de una solución hipertónica que se utiliza para alimentar a las personas que no pueden comer normalmente por la boca.
Manitol al 25%
Esta es una solución utilizada frecuentemente para tratar los golpes en la cabeza. Es cuatro veces más concentrada que la sangre.
Solución salina al 7,5%
Es una solución esterilizada de sal bastante concentrada que también se les inyecta por las venas a algunos pacientes con ciertas enfermedades.
Los jugos comerciales
Todos los jugos que se compran en el supermercado y que no sean naturales, tienen concentraciones de azúcar muy altas que los hacen hipertónicos.
Referencias
- Sweeney J. Managing hypernatremia. Nursing. septiembre 2010;40(9):63.
- Brine. Wikipedia. 2021. Tomado de en.wikipedia.org/wiki/Brine.
- Seawater. Wikipedia. 2021. Tomado de en.wikipedia.org/wiki/Seawater.
- Chavalittamrong B, Pidatcha P, Thavisri U. Electrolytes, sugar, calories, osmolarity and pH of beverages and coconut water. Southeast Asian J Trop Med Public Health. September 1982;13(3):427-431.
- 5% Dextrose and 0.45% Sodium Chloride Injection, USP. FDA. 2006. Tomado de accessdata.fda.gov/drugsatfda_docs/label/2006/017607s123lbl.pdf.
- Llorente G, Niño MC. Manitol versus solución salina hipertónica en neuroanestesia. Revista Colombiana de Anestesiología. enero-marzo 2015;43(1):29-39.
- Santos MM,e. Treatment of acute rumen lactic acidosis with intravenous hypertonic sodium chloride or bicarbonate solutions followed by intraruminal water. Research in Veterinary Science. febrero 2020;128:24-34.
- Dini-G. E, Abreu-C. JD, López-M. E. Osmolalidad de bebidas de consumo frecuente. Investigación Clínica. diciembre 2004;45(4).
