Carbocatión: formación, características, tipos, estabilidades
Un carbocatión, como su nombre indica, es un ion orgánico que posee un átomo de carbono cargado positivamente, el cual se caracteriza por ser altamente inestable, existiendo por poco tiempo. Suele tratarse de un intermediario en las reacciones orgánicas, es decir, se origina como pasos indispensables de los respectivos mecanismos moleculares.
Históricamente ha habido puntos de conflictos en la compresión de qué es un carbocatión. Esto se debe a que existen sinfines de moléculas reactivas que, por alguna u otra razón, adquieren una carga positiva en uno de sus carbonos. El carbocatión clásico, por decirlo así, es aquel que puede representarse mediante la fórmula general de la imagen de abajo.

Nótese cómo la carga positiva se localiza exactamente sobre el átomo de carbono, y que le falta además un enlace. Por lo tanto, el carbocatión es deficiente de electrones, siendo esta la causa de su alta reactividad.
Supóngase el metano, CH4. Si el carbono perdiera uno de sus átomos de hidrógeno, estaríamos eliminando uno de los cuatro enlaces C-H. Entonces se originaría el carbocatión metilo, CH3+, el cual pudiéramos representar con solo colocando los átomos de hidrógeno en los extremos de las rayas de la fórmula superior. El CH3+ es el más simple de todos los carbocationes.
Índice del artículo
¿Cómo se forman los carbocationes? La respuesta se encuentra en los mecanismos de las reacciones. Sin embargo, la gran mayoría comparten en común uno de los siguientes dos aspectos:
-Ruptura heterolítica
-Adición de electrones π a un electrófilo
En la ruptura heterolítica el enlace C-G, siendo G cualquier átomo o grupo, se rompe de manera desigual: los electrones del enlace se los queda G, mientras el átomo de carbono adquiere una carga positiva. Por ejemplo:

Ahora bien, esta ruptura puede darse por varios métodos, lo cual a su vez cambiará el mecanismo y la reacción considerados.
El otro proceso por el cual se forma un carbocatión, siendo muy común en alquenos y compuestos aromáticos, es mediante el ataque de los electrones de un doble enlace a un electrófilo. Los casos más comunes son las hidrogenaciones de los alquenos por acción de un ácido:

Esta ecuación corresponde a la formación del carbocatión, el cual es unintermediario, no un producto. Los electrones π del doble enlace atacan el hidrógeno del HCl, el electrófilo. El hidrógeno se adiciona al carbono de la derecha del doble enlace, por lo que se forma el grupo -CH3, mientras que el carbono de la izquierda adquiere la carga positiva.
La fórmula general presentada al principio revela una geometría plano trigonal entorno al átomo de carbono. Esto se debe a la hibridación que sufren los orbitales atómicos del carbono para convertirse en orbitales híbridos sp2, los cuales se separan en un ángulo de 120º. Aunque no se represente, el carbocatión posee un orbital p puro y vacío, capaz de aceptar electrones.
El carbocatión es una especie en extremo ácida, ya sea según la definición de Brönsted o de Lewis. Su carga positiva demanda electrones u átomos de hidrógeno que se los cedan. Es por esta razón que los carbocationes no pueden formarse en medios muy básicos, ya que reaccionarían de inmediato para originar otros productos.
La hibridación sp2 del carbocatión lo vuelve vulnerable a los ataques de especies ricas en electrones. Esta característica se acentúa todavía más por su gran acidez. En consecuencia, el carbocatión es una especie muy reactiva, que apenas se forma y al poco tiempo (en cuestión de nanosegundos) reaccionan para dar lugar al verdadero producto de la reacción química.
Existen varios tipos de carbocationes. Sin embargo, estos pueden clasificarse de acuerdo a como sigue:
-Primarios
-Secundarios
-Terciarios
-Aromáticos o arilos
-Vinílicos y alílicos
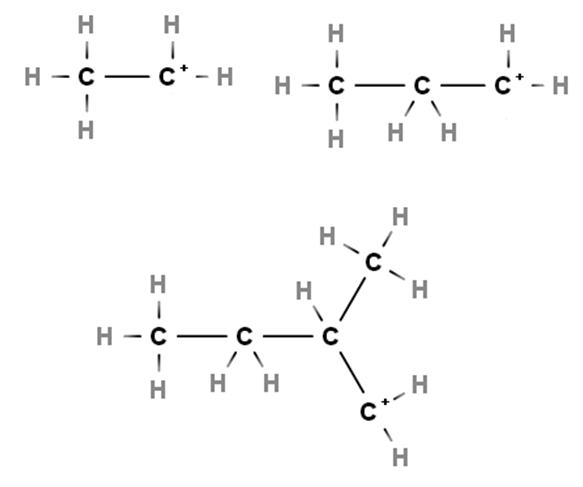
Arriban se muestran ejemplos de carbocationes primarios. Se llaman así porque la carga positiva reside en un carbono primario, 1º, por lo que solo está enlazado a un átomo de carbono. El etano, CH3CH3, cuando pierde un H de cualquiera de sus extremos se origina el carbocatión CH3CH2+ o +CH2CH3.
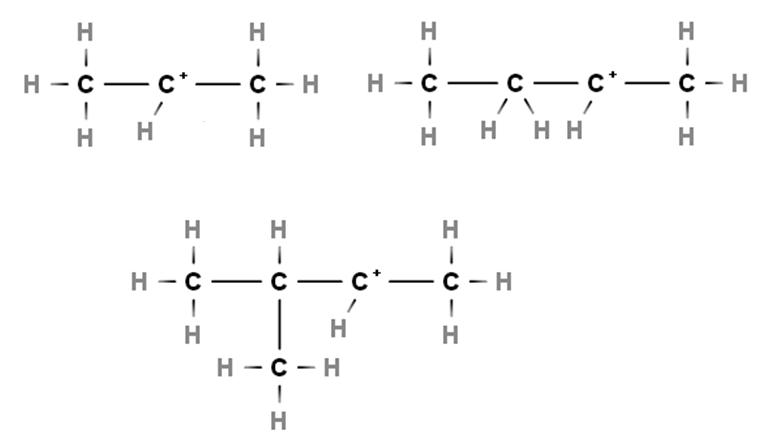
En los carbocationes secundarios la carga positiva se localiza en un carbono secundario, 2º, el cual está enlazado a dos átomos de carbono. Por ejemplo, si al propano, CH3CH2CH3, le quitamos un H del carbono central, tendremos el carbocatión CH3CH2+CH3.
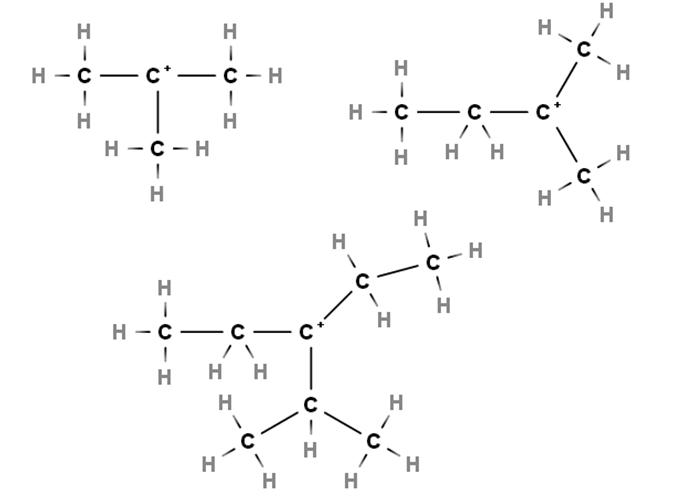
En los carbocationes terciarios la carga positiva se localiza en un carbono terciario, 3º, enlazado a tres átomos de carbono. Nótese que a diferencia de los primeros dos tipos de carbocationes, estos carecen de átomos de hidrógeno.
Así, tenemos al metilpropano o isobutano, CH(CH3)3, el cual al perder un hidrógeno el carbono central se forma el carbocatión +C(CH3)3.

Los carbocationes aromáticos o arílicos son quizás los más especiales de todos. Su formación es muy similar a la descrita para los alquenos en el primer apartado.
En ellos, la carga positiva se localiza, en principio, en uno de los carbonos de un anillo aromático, como el del benceno. Sin embargo, la carga positiva no está fija, sino que se dispersa en otras posiciones del anillo mediante resonancia.
Es así cómo la carga positiva, tal como se aprecia arriba, pasa de un carbono a otro dentro del anillo de benceno. Esta característica le confiere a este carbocatión una gran estabilidad frente a los otros tipos de carbocationes.

Otros tipos especiales de carbocationes son los alílicos y los vinílicos. La diferencia entre ellos (arriba) es la posición de la carga positiva relativa al doble enlace.
En el carbocatión vinílico la carga positiva se encuentra en uno de los carbonos del doble enlace; mientras que en el carbocatión alílico, la carga positiva se localiza en el carbono siguiente al doble enlace. Basta con sustituir los hidrógenos por otros grupos y tendremos una familia enorme de carbocationes alílicos y vinílicos.
Sabiendo cuáles son los principales tipos de carbocationes, se pueden ordenar en función de sus estabilidades relativas:
Vinílico Primario Secundario Alílico Terciario Aromático
Ahora bien, puede haber carbocationes alílicos que sean más estables que uno terciario en específico. Todo dependerá de sus sustituyentes.
¿A qué se debe dicha estabilidad? A la capacidad que tiene la molécula de dispersar o disminuir la carga positiva del carbocatión. Para ello, necesita de átomos cercanos que cedan parte de su densidad electrónica al carbocatión mediante hiperconjugación. Mientras, en los carbocationes alílicos y aromáticos esto se logra mediante resonancia.
En el caso del carbocatión vinílico, la carga positiva se localiza sobre un carbono que de por sí ya era sp2, lo cual lo hace muy inestable.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Carbocation. Recuperado de: en.wikipedia.org
- James Ashenhurst. (20 de febrero de 2020). 3 Factors That Stabilize Carbocations. Recuperado de: masterorganicchemistry.com
- Clark Jim. (2000). Carbocations (or carbonium ions). Recuperado de: chemguide.co.uk
- Dr. Kennepohl, Prof. S. Farmer & T. Soderberg. (10 de agosto de 2020). Carbocation Structure and Stability. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
