Cloruro ferroso (FeCl2): estructura, usos, propiedades
El cloruro ferroso es un sólido inorgánico formado por la unión de un catión Fe2+ y dos aniones cloruro Cl–. Su fórmula química es FeCl2. Tiende a absorber agua del ambiente. Uno de sus hidratos es el tetrahidrato FeCl2•4H2O el cual es un sólido verdoso.
Destacar que es muy soluble en agua y tiende a oxidarse fácilmente en presencia de aire formando el cloruro férrico FeCl3. Por ser fácilmente oxidable y por lo tanto capaz de actuar como reductor es muy utilizado en los laboratorios de investigación química y biológica.

El cloruro ferroso tiene varios usos entre los que destaca el de ayudar a otros agentes en la oxidación de los lodos derivados del tratamiento de aguas residuales o cloacales. También se usa en el proceso de recubrimiento con hierro de metales y posee algunos usos en la industria farmacéutica.
También se ha experimentado la utilización de FeCl2 en la recuperación de metales valiosos de los catalizadores gastados que se encuentran en los tubos de escape de los vehículos que funcionan con gasolina o diésel.
Se emplea en la industria textil para fijar los colores en algunos tipos de tela.
Índice del artículo
El cloruro ferroso está formado por un ion ferroso Fe2+ y dos iones cloruro Cl– unidos mediante enlaces iónicos.
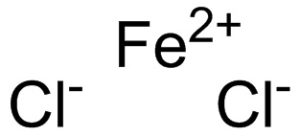
El ion ferroso Fe2+ posee la siguiente estructura electrónica:
1s2, 2s2 2p6, 3s2 3p6 3d6, 4s0
donde se puede observar que perdió dos electrones de la capa 4s.
Esta configuración no es muy estable, y por esta razón tiende a oxidarse, es decir, perder otro electrón, esta vez de la capa 3d, formando el ion Fe3+.
Por su parte el ion cloruro Cl– posee la siguiente estructura electrónica:
1s2, 2s2 2p6, 3s2 3p6
donde se puede ver que adquirió un electrón adicional en la capa 3p, completándola. Esta configuración es muy estable porque todas las capas electrónicas están completas.
– Cloruro ferroso
– Cloruro de hierro (II)
– Dicloruro de hierro
– Cloruro ferroso tetrahidratado: FeCl2•4H2O
Sólido de incoloro a verde pálido, cristales.
126,75 g/mol
674 ºC
1023 ºC
3,16 a 25 ºC/4 ºC
Muy soluble en agua: 62,5 g/100 mL a 20 ºC. Soluble en alcohol, acetona. Ligeramente soluble en benceno. Prácticamente insoluble en éter.
El FeCl2 anhidro es muy higroscópico. Absorbe agua con facilidad del ambiente, formando variedad de hidratos, especialmente el tetrahidrato, en el cual por cada molécula de FeCl2 hay 4 moléculas de H2O unidas a este (FeCl2•4H2O).
En presencia de aire se va oxidando lentamente a FeCl3. Esto significa que el ion Fe2+ se oxida fácilmente a ion Fe3+.
Si se calienta en presencia de aire forma rápidamente cloruro férrico FeCl3 y óxido férrico Fe2O3.
El FeCl2 es corrosivo para los metales y tejidos.
Se obtiene tratando un exceso de metal hierro Fe con solución acuosa de ácido clorhídrico HCl a altas temperaturas.
Fe0 + 2 HCl → FeCl2 + 2 H+
Sin embargo, debido a la presencia de agua mediante este método se obtiene el cloruro ferroso tetrahidratado FeCl2•4H2O.
Para obtenerlo anhidro (sin agua incorporada en los cristales) algunos investigadores han optado por realizar la reacción de polvo de hierro con HCl anhidro (sin agua) en el solvente tetrahidrofurano (THF) a una temperatura de 5 ºC.
Se obtiene de esta forma el compuesto FeCl2•1,5THF, el cual al ser calentado a 80-85 ºC al vacío o en atmósfera de nitrógeno (para evitar la presencia de agua) produce el FeCl2 anhidro.
El cloruro ferroso posee diversos usos basados generalmente en su capacidad reductora, es decir, que puede ser fácilmente oxidado. Se usa por ejemplo en pinturas y recubrimientos, pues ayuda a fijarlos de la superficie.
El hierro es un micronutriente esencial para la salud humana y de algunos animales. Está involucrado en la síntesis de proteínas, en la respiración y en la multiplicación de las células.
Por ello el FeCl2 se emplea en preparaciones farmacéuticas. El ion Fe2+ como tal se absorbe mejor que el ion Fe3+ en el intestino.
Se usa para la manufactura de FeCl3. Es utilizado en metalurgia, en baños de recubrimientos de hierro, para proporcionar un depósito más dúctil.
A continuación otros usos destacados.
El FeCl2 es empleado como mordiente o fijador de colorantes en algunos tipos de tela. El mordiente reacciona químicamente y se une de forma simultánea al tinte y a la tela formando un compuesto insoluble sobre esta.
De esta forma, el colorante queda fijo a la tela y se intensifica su color.

El FeCl2 se emplea en las plantas de tratamiento de aguas residuales o de desecho (aguas de cloaca).
En esta aplicación el cloruro ferroso participa en la oxidación del lodo, mediante un proceso denominado oxidación de Fenton. Esta oxidación causa la ruptura de los flóculos de lodo y permite la liberación del agua que se encuentra fuertemente unida a este.
Luego el lodo puede secarse y desecharse de manera ecológica. La utilización del cloruro ferroso ayuda a disminuir los costos del proceso.
También se ha propuesto recientemente emplearlo para disminuir la formación de gas sulfhídrico o sulfuro de hidrógeno en dichas aguas de cloaca.
De esta forma se disminuiría la corrosión producida por este gas y también los olores desagradables.
Por sus propiedades reductoras (lo contrario de oxidante) el FeCl2 es ampliamente usado en diversas investigaciones en laboratorios de química, física e ingeniería.
Ciertos científicos utilizaron vapores de cloruro ferroso para extraer metales valiosos como platino, paladio y rodio de catalizadores gastados de vehículos que funcionan con gasolina o diesel.
Estos catalizadores se usan para eliminar gases nocivos para el ser humano y el ambiente. Están ubicados en el tubo de escape de los automóviles y camiones que funcionan con gasolina o diésel.

Pasado cierto tiempo el catalizador del vehículo se gasta y pierde efectividad y hay que sustituirlo. El catalizador gastado se desecha y se están realizando esfuerzos para recuperar los metales valiosos que este contiene.

Según los investigadores, con el hierro del cloruro ferroso dichos metales formaron aleaciones magnéticas.
Las aleaciones pudieron ser extraídas con imanes y luego recuperados los metales valiosos por métodos ya conocidos.
Por poseer el catión Fe2+, el cual es un micronutriente importante en el ser humano y algunos animales, el FeCl2 se usa en estudios de bioquímica y medicina.
Ciertos estudios permitieron demostrar que el cloruro ferroso mejora la eficacia fungicida del plasma frío de argón.
El plasma frío es una tecnología utilizada para la esterilización de superficies e instrumentos médicos. Está basada en la formación de radicales hidroxilo OH· a partir de la humedad del ambiente. Estos radicales reaccionan con la pared celular del microorganismo y ocasionan su muerte.
En esta investigación el FeCl2 mejoró el efecto del plasma frío y aceleró la eliminación de un hongo resistente a otros métodos de desinfección.
Algunos científicos encontraron que la utilización de FeCl2 permite aumentar el rendimiento en las reacciones de obtención de glucosa partiendo de bagazo de caña de azúcar.
En este caso, siendo el Fe2+ un microelemento esencial para la salud humana, su presencia en trazas en el producto no afectaría al ser humano.
- Fukuda, S. et al. (2019). Ferrous chloride and ferrous sulfate improve the fungicidal efficacy of cold atmospheric argon plasma on melanized Aureobasidium pullulans. J Biosci Bioeng, 2019, 128(1):28-32. Recuperado de ncbi.clm.nih.gov.
- Ismal, O.E. and Yildirim, L. (2019). Metal mordants and biomordants. In The Impact and Prospects of Green Chemistry for Textile Technology. Chapter 3, pp.57-82. Recuperado de sciencedirect.com.
- Zhang, W. et al. (2019). Co-catalysis of magnesium chloride and ferrous chloride for xylo-oligosaccharides and glucose production from sugarcane bagasse. Bioresour Technol 2019, 291:121839. Recuperado de ncbi.nlm.nih.gov.
- Zhou, X. et al. (2015). Role of indigenous iron in improving sludge dewaterability through peroxidation. Scientific Reports 5:7516. Recuperado de ncbi.nlm.nih.gov.
- Rathnayake, D. et al. (2019). Hydrogen sulphide control in sewers by catalyzing the reaction with oxygen. Science of the Total Environment 689 (2019) 1192-1200. Recuperado de ncbi.nlm.nih.gov.
- Taninouchi, Y. and Okabe, T.H. (2018). Recovery of Platinum Group Metals from Spent Catalysts Using Iron Chloride Vapor Treatment. Metall and Materi Trans B (2018) 49:1781. Recuperado de link.springer.com.
- U.S. National Library of Medicine. (2019). Ferrous Chloride. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). Iron(0) Oxidation by Hydrogen Chloride in Tetrahydrofuran: a Simple Way to Anhydrous Iron(II) Chloride. Inorganic Chemistry, Vol. 16, No. 7, 1977. Recuperado de pubs.acs.org.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
