Compuestos especiales: características, formación, usos
Los compuestos especiales son todos aquellos conformados por los hidruros covalentes de los carbonoideos y nitrogenoides. Se trata de compuestos con fórmula EH4, para los carbonoideos o elementos del grupo 14, o fórmula EH3 para los nitrogenoides o elementos del grupo 15.
No está muy clara la razón de por qué algunos químicos se refieren a estos hidruros como compuestos especiales; este nombre puede ser relativo aunque, obviando que entre ellos no se encuentra el H2O, algunos son muy inestables y raros, por lo que podrían ser dignos de tal calificativo.
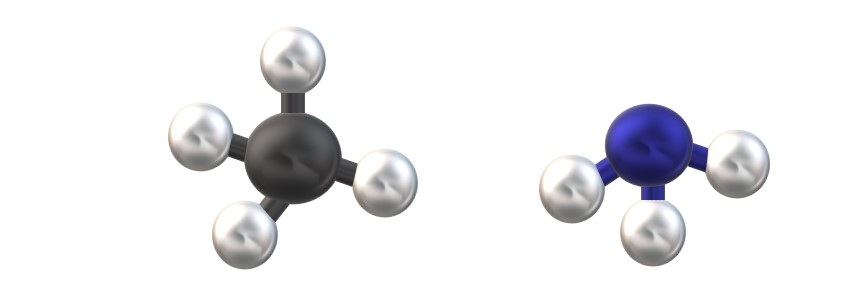
En la imagen superior se muestran dos moléculas de hidruros EH4 (izquierda) y EH3 (derecha) con un modelo de esferas y barras. Nótese que los hidruros EH4 son tetraédricos, mientras que los EH3 tienen geometría pirámide trigonal, con un par de electrones encima del átomo central E.
A medida que se desciende por los grupos 14 y 15, el átomo central crece y la molécula se torna más pesada e inestable; dado que se debilitan los enlaces E-H por el pobre solapamiento de sus orbitales. Los hidruros más pesados quizás sean los verdaderos compuestos especiales, mientras que el CH4, por ejemplo, es bastante abundante en la naturaleza.
Índice del artículo
Al dividirse los compuestos especiales en dos grupos definidos de hidruros covalentes, se dará una breve descripción de sus características por separado.
Como se hizo mención al principio, sus fórmulas son EH4 y consisten de moléculas tetraédricas. El más simple de estos hidruros es el CH4, el cual irónicamente también se clasifica como un hidrocarburo. Lo más importante de esta molécula es la estabilidad relativa de sus enlaces C-H.
Asimismo, los enlaces C-C son muy fuertes, ocasionando que el CH4 pueda concatenarse para originar la familia de los hidrocarburos. De esta manera surgen cadenas C-C de grandes longitudes y con muchos enlaces C-H.
No ocurre igual con sus homólogos más pesados. El SiH4, por ejemplo, presenta enlaces Si-H muy inestables, lo que hace de este gas un compuesto más reactivo que el propio hidrógeno. Además, sus concatenaciones no son muy eficientes ni estables, originando cadenas Si-Si de apenas diez átomos como mucho.
Entre tales productos de concatenación están los hexahidruros, E2H6: C2H6 (etano), Si2H6 (disilano), Ge2H6 (digermano), y Sn2H6 (diestannano).
Los otros hidruros: GeH4, SnH4 y PbH4 son gases aún más inestables y explosivos, de los cuales se aprovecha su acción reductora. Al PbH4 se le considera como un compuesto teórico, ya que es tan reactivo que no ha podido obtenerse apropiadamente.
Por el lado de los hidruros nitrogenoides o del grupo 15, encontramos las moléculas pirámides trigonales EH3. Estos compuestos también son gaseosos, inestables, incoloros y tóxicos; pero más versátiles y útiles que los EH4.
Por ejemplo, el NH3, el más simple de ellos, es uno de los compuestos químicos que más se producen a nivel industrial, y su olor desagradable lo caracteriza muy bien. El PH3 por su parte huele a ajo y pescado, y el AsH3 huele a huevos podridos.
Todas las moléculas EH3 son básicas; pero el NH3 se corona en esta característica, siendo la base más fuerte debido a la mayor electronegatividad y densidad electrónica del nitrógeno.
El NH3 también puede concatenarse, al igual que el CH4, solo que en un grado mucho menor; la hidracina, N2H4 (H2N-NH2), y el triazano, N3H5 (H2N-NH-NH2), son ejemplos de compuestos originados por la concatenación del nitrógeno.
Similarmente los hidruros PH3 y AsH3 se concatenan para originar P2H4 (H2P-PH2), y As2H4 (H2As-AsH2), respectivamente.
Para nombrar a estos compuestos especiales se hace uso de dos nomenclaturas la mayoría de las veces: la tradicional y la IUPAC. Abajo se desglosarán los hidruros EH4 y EH3 con sus respectivas fórmulas y nombres.
– CH4: metano.
– SiH4: silano.
– GeH4: germano.
– SnH4: estannano.
– PbH4: plumbano.
– NH3: amoníaco (tradicional), azano (IUPAC).
– PH3: fosfina, fosfano.
– AsH3: arsina, arsano.
– SbH3: estibina, estibano.
– BiH3: bismutina, bismutano.
Por supuesto, también pueden utilizarse las nomenclaturas sistemática y stock. En la primera se especifica el número de átomos de hidrógeno con los prefijos griegos di, tri, tetra, etc. El CH4 vendría a llamarse según esta nomenclatura tetrahidruro de carbono. Mientras que según la nomenclatura stock, el CH4 se llamaría hidruro de carbono (IV).
Cada uno de estos compuestos especiales presenta múltiples métodos de preparación, ya sea a escalas industriales, de laboratorio, e incluso en procesos biológicos.
El metano se forma mediante varios fenómenos biológicos donde las altas presiones y temperaturas fragmentan hidrocarburos de mayores masas moleculares.
Se acumula en bolsas enormes de gases en equilibrio con el petróleo. Asimismo, en las profundidades del ártico permanece encerrado en cristales de hielo llamado clatratos.
El silano es menos abundante, y uno de los muchos métodos por los cuales se produce está representado con la siguiente ecuación química:
6H2(g) + 3SiO2(g) + 4Al(s) → 3SiH4(g) + 2Al2O3(s)
Respecto al GeH4, se sintetiza a nivel de laboratorio de acuerdo a las siguientes ecuaciones químicas:
Na2GeO3 + NaBH4 + H2O → GeH4 + 2 NaOH + NaBO2
Y el SnH4 se forma cuando reacciona con el KAlH4 en un medio de tetrahidrofurano (THF).
El amoníaco, al igual que el CH4, puede formarse en la naturaleza, especialmente en el espacio exterior en forma de cristales. El principal proceso por el cual se obtiene el NH3 es mediante el de Haber-Bosch, representado por la siguiente ecuación química:
3 H2(g) + N2(g) → 2 NH3(g)
El proceso implica el uso de altas temperaturas y presiones, además de catalizadores para promover la formación del NH3.
La fosfina se forma cuando se trata el fósforo blanco con hidróxido de potasio:
3 KOH + P4 + 3 H2O → 3 KH2PO2 + PH3
La arsina se forma cuando reaccionan sus arseniuros metálicos con ácidos, o cuando se trata una sal de arsénico con el borohidruro de sodio:
Na3As + 3 HBr → AsH3 + 3 NaBr
4 AsCl3 + 3 NaBH4 → 4 AsH3 + 3 NaCl + 3 BCl3
Y la bismutina cuando se desproporciona el metilbismutina:
3 BiH2CH3 → 2 BiH3 + Bi(CH3)3
Para finalizar se mencionan algunos de los muchos usos de estos compuestos especiales:
– El metano es un combustible fósil utilizado como gas de cocina.
– El silano se utiliza en síntesis orgánicas de organosilicios al adicionar a los dobles enlaces de los alquenos y/o alquinos. Asimismo, a partir de él puede depositarse el silicio durante la fabricación de semiconductores.
– Al igual que el SiH4, el germano también se destina para añadir átomos de Ge a modo de películas en los semiconductores. Lo mismo aplica para la estibina, adicionando átomos de Sb sobre superficies de silicio mediante electrodeposición de sus vapores.
– La hidracina se ha utilizado como combustible de cohetes y para extraer metales preciosos.
– El amoníaco se destina para la industria de los fertilizantes y farmacéutica. Prácticamente es una fuente reactiva de nitrógeno, permitiendo adicionar los átomos de N a infinidad de compuestos (aminación).
– La arsina se llegó a considerar como arma química durante la Segunda Guerra Mundial, quedándose en su lugar el infame gas fosgeno, COCl2.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Química. (30 de abril de 2016). Compuestos especiales. Recuperado de: websterquimica.blogspot.com
- Alonso Formula. (2018). H with no metal. Recuperado de: alonsoformula.com
- Wikipedia. (2019). Group 14 hydride. Recuperado de: en.wikipedia.org
- The Chemistry guru. (s.f.). Hydrides of nitrogen. Recuperado de: thechemistryguru.com
