Cloruro de aluminio (AlCl3): estructura, propiedades, usos, riesgos
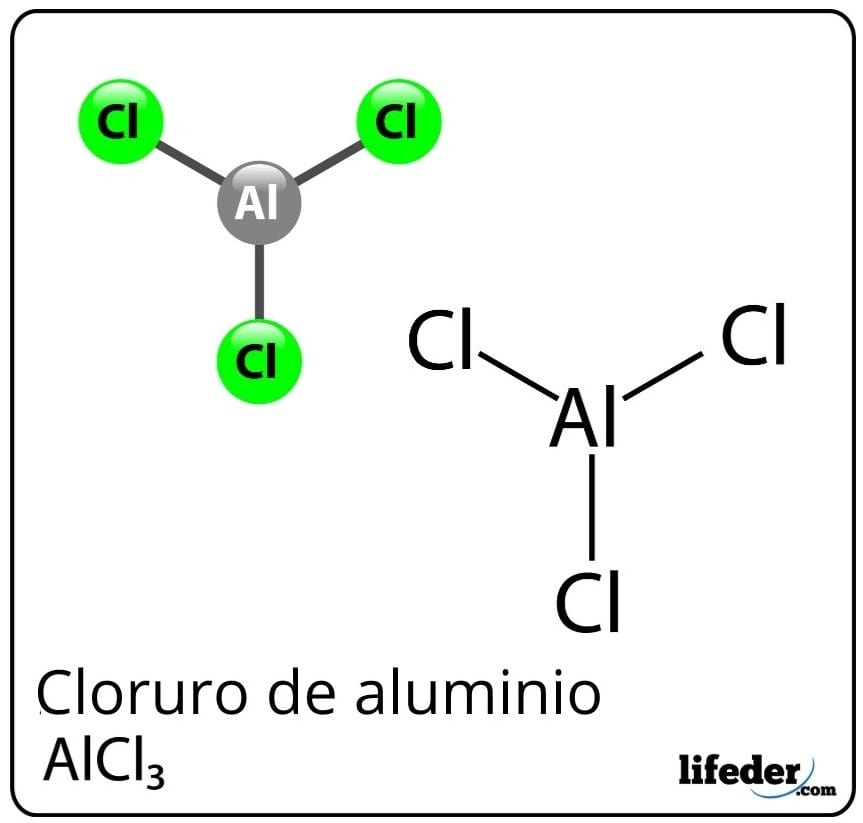
¿Qué es el cloruro de aluminio?
El cloruro de aluminio es un compuesto químico inorgánico cuya fórmula es AlCl3. Se presenta como un sólido o polvo blanco, aunque debido a una contaminación con cloruro férrico, y a la humedad, puede tornarse de color amarillo. Consiste en un ácido de Lewis, pero bajo ciertas circunstancias se comporta también como una base de Lewis.
A pesar de ser clasificado el aluminio como un metal en la tabla periódica, existe un enlace covalente entre el aluminio y el cloro para formar el cloruro de aluminio.
Este enlace covalente podría explicar el porqué el cloruro de aluminio fundido es un mal conductor de la electricidad; mientras que las sales fundidas de otros compuestos, como el cloruro de sodio, son buenas conductoras de la electricidad.
El cloruro de aluminio se produce por una reacción exotérmica entre el aluminio y cloro, o cloruro de hidrógeno, a una temperatura comprendida entre 650 y 750 ºC.
El cloruro de aluminio se utiliza como antitranspirante y para combatir la sudoración excesiva. Uno de sus derivados se usa como agente coagulante en el tratamiento de las aguas residuales industriales, y además se utiliza como el principal catalizador en las reacciones químicas de la industria.
Estructura del cloruro de aluminio
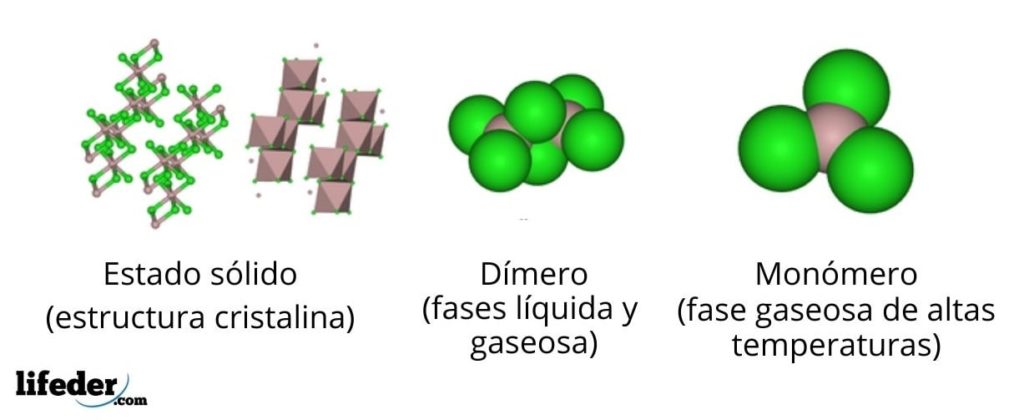
En la imagen superior tenemos distintas representaciones para cada una de las estructuras cristalinas o moleculares que exhibe el cloruro de aluminio anhidro, AlCl3, en varios de sus estados físicos.
El AlCl3 sólido consiste en una estructura cristalina monoclínica formada por capas de octaedros coordinados entre sí. En estos octaedros (color marrón), el ion Al3+ está coordinado con seis iones Cl–, actuando los cloruros como puentes entre dos octaedros.
Cuando la temperatura se incrementa y se funde el AlCl3, las capas se separan en unidades Al2Cl6 (centro de la imagen). Ahora, el átomo de aluminio forma enlaces con tres átomos de cloro y un enlace con el otro átomo de aluminio: Cl3Al-AlCl3. Estos dímeros explican por qué el AlCl3 fundido es menos denso que sus cristales.
En la fase de vapor, los dímeros Al2Cl6 se distancian unos de otros. Pero si a este vapor se le somete a altas temperaturas, el dímero se disocia en unidades moleculares AlCl3, en las que el átomo de aluminio forma tres enlaces con los átomos de cloro. El AlCl3 presenta una geometría plano trigonal.
Propiedades del cloruro de aluminio

Fórmulas
AlCl3 (anhidro)
AlCl3·6H2O (hexahidrato)
Masa molar
133.34 g/mol (anhidro)
241.43 g/mol (hexahidrato)
Apariencia física
Sólido cristalino o polvo de color blanco. Puede tornarse con una tonalidad amarillenta por la contaminación con cloruro férrico. También puede cambiar a un color grisáceo por la humedad.
Punto de fusión
192.4 ºC
Punto de ebullición
Sublima a 178 ºC, por lo que no es fácil obtener el punto de ebullición del cloruro de aluminio.
Densidad
2.48 g/cm3 (anhidro)
2.398 g/cm3 (hexahidrato)
Solubilidad en agua
439 g/L a 0 ºC
458 g/L a 20 ºC
466 g/L a 30 ºC
El cloruro de aluminio es un compuesto higroscópico que puede absorber agua del aire húmedo, emitiendo un humo durante el proceso.
Solubilidad en otros disolventes
Soluble en etanol, cloroformo, tetracloruro de carbono, benzofenona y nitrobenceno. Ligeramente soluble en benceno.
Presión de vapor
13.3 kPa a 151 ºC (0.131 atm).
Viscosidad
0.35 cP a 197 ºC
Reactividad
El cloruro de aluminio es una sustancia anfótera, es decir, se comporta como un ácido o una base. Sin embargo, su acción como ácido es preponderante, ya que el cloruro de aluminio se utiliza como un ácido de Lewis y al mismo tiempo es un catalizador en muchas reacciones químicas; entre ellas, la reacción de Friedel-Crafts.
Inclusive, se clasifica al cloruro de aluminio como un ácido, en lugar de hacerlo como una sal.
El cloruro de aluminio anhidro en solución acuosa se transforma en la sal hexahidratada (AlCl3·6H2O), la cual no regresa a la forma anhidra por calentamiento.
Los átomos de aluminio de dos moléculas de AlCl3 interactúan entre sí para completar 8 electrones en su capa de valencia, lo cual resulta en la formación del dímero Al2Cl6. Este dímero está presente en el cloruro de aluminio fundido y en el vapor.
El cloruro de aluminio reacciona con el hidróxido de sodio para formar hidróxido de aluminio, un precipitado gelatinoso:
AlCl3 + NaOH → Al(OH)3 + 3 NaCl
Aplicaciones del cloruro de aluminio
Antitranspirante y antihemorrágico

El cloruro de aluminio se usa como antitranspirante en los desodorantes personales, y además se usa para controlar la sudoración excesiva (hiperhidrosis). También se usa en formulaciones para controlar hemorragias pequeñas, tales como las que se presentan en los tratamientos dentales.
Tratamiento de aguas residuales
El cloruro de aluminio bajo la forma de PAC (cloruro de polialuminio), es utilizado como coagulante en el tratamiento de las aguas residuales industriales, debido a su capacidad de clarificar el agua y deshidratar los lodos.
Catalizador
El cloruro de aluminio es unos de los principales catalizadores que se utilizan en la industria, actuando como catalizador en numerosas reacciones, entre ellas la de Friedel-Crafts.
El cloruro de aluminio cataliza las reacciones de preparación de las antraquinonas, algunas de las cuales se utilizan en la industria textil. También existen antraquinonas que tienen propiedades antibacterianas, antiparasitarias, fungicidas y antivirales.
El cloruro de aluminio cataliza las reacciones que producen el dodecilbenceno, usado en la producción de detergentes, y el etilbenceno, compuesto utilizado en la fabricación de poliestireno, polímero empleado en la elaboración de plásticos, resinas y hule.
También se utiliza el cloruro de aluminio como catalizador en una reacción que forma parte de la producción de gasolina de alto octanaje. Asimismo, cataliza el proceso de craqueo del petróleo.
Riesgos
El cloruro de aluminio es una sustancia corrosiva y su contacto puede producir irritación y lesiones en la piel y en los ojos, llegando a producir un daño ocular.
Al disolverse en el agua puede desprender gases venenosos, como el cloruro de hidrógeno; gases capaces de producir por inhalación una irritación de la nariz y garganta, pudiendo causar tos e irritación pulmonar. Esta irritación puede llevar a la acumulación de líquido en los pulmones (edema pulmonar), lo que termina en una emergencia médica.
Se ha tratado de establecer una conexión entre la generación de la enfermedad de Alzheimer y el cloruro de aluminio; aunque los resultados de la investigación no son concluyentes.
Asimismo, se ha investigado la conexión entre el uso de desodorantes que emplean como antitranspirante al AlCl3 y el cáncer de seno. La investigación al respecto no ha podido demostrar una relación concluyente. En todo caso, el cloruro de aluminio bloquea el funcionamiento de un sistema de desintoxicación natural del organismo y de la emisión de calor, como es el sudor.
Referencias
- Wikipedia. (2021). Aluminium chloride. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information (2021). Aluminum chloride, PubChem Compound Summary for CID 24012. Recuperado de: pubchem.ncbi.nlm.nih.gov
- NJ Health. (2008). Hazardous Substance Fact Sheet: Aluminum Chloride. [PDF]. Recuperado de: nj.gov
- Encyclopaedia Britannica. (2021). Aluminum chloride. Recuperado de: britannica.com
- Elsevier B.V. (2021). Anthraquinones. ScienceDirect. Recuperado de: sciencedirect.com
- John P. Cunha. (02 de mayo de 2020). Aluminum Chloride Topical. Recuperado de: rxlist.com
