Cromo: qué es, propiedades, características y usos

¿Qué es el cromo?
El cromo (Cr) es un elemento químico del grupo 6 (VIB) de la tabla periódica. Anualmente se producen toneladas de este metal mediante su extracción del mineral cromita de hierro o de magnesio (FeCr2O4, MgCr2O4), los cuales se reducen con carbón para obtener el metal. Es muy reactivo, y solo en condiciones muy reductoras se encuentra en su forma pura.
Su nombre deriva de la palabra griega chroma, que significa color. Se le dio este nombre a raíz de los múltiples e intensos colores que exhiben los compuestos de cromo, ya sean inorgánicos u orgánicos; desde sólidos o soluciones negras, hasta amarillas, anaranjadas, verdes, violetas, azules y rojas.
Sin embargo, el color del cromo metálico y sus carburos son grisáceos plateados. Esta característica se aprovecha en la técnica de cromado para dar a muchas estructuras destellos plateados (como los que se pueden observar en modelos de grifos de baños y cocinas, por ejemplo).
Así, “bañando con cromo” a las piezas se les dan lustre y una gran resistencia frente a la corrosión.
El cromo en solución reacciona rápidamente con el oxígeno del aire para formar óxidos. Dependiendo del pH y de las condiciones oxidativas del medio puede adquirir distintos números de oxidación, siendo el (III)(Cr3+) el más estable de todos. En consecuencia, el óxido de cromo (III) (Cr2O3) de color verde es el más estable de sus óxidos.
Estos óxidos pueden interaccionar con otros metales del entorno originando, por ejemplo, el pigmento plomo rojo siberiano (PbCrO4). Este pigmento es de color amarillo-anaranjado o rojo (de acuerdo a su alcalinidad), y a partir de él el científico francés Louis Nicolas Vauquelin (1763-1829) aisló el cobre metálico, razón por la que es considerado su descubridor.
Sus minerales y óxidos, así como una porción diminuta de cobre metálico, hacen que este elemento ocupe el número 22 de los más abundantes de la corteza terrestre.
La química del cromo es muy diversa debido a que puede formar enlaces con casi toda la tabla periódica entera. Cada uno de sus compuestos exhibe colores que dependen del número de oxidación, así como de las especies que interaccionen con él.
Asimismo, forma enlaces con el carbono, interviniendo en un gran número de compuestos organometálicos.
Características y propiedades del cromo
El cromo es un metal plateado en su forma pura, con el número atómico 24 y un peso molecular de aproximadamente 52 g/mol (52Cr, su isótopo más estable).
Dados sus fuertes enlaces metálicos, presenta puntos de fusión (1907 ºC) y ebullición (2671 ºC) altos. Asimismo, su estructura cristalina hace de él un metal muy denso (7.19 g/mL).
No reacciona con el agua para formar hidróxidos, pero sí con los ácidos. Se oxida con el oxígeno del aire produciendo generalmente óxido crómico, el cual es un pigmento verde muy utilizado.
Estas capas de óxido crean lo que se conoce como pasivación, protegiendo el metal de posteriores corrosiones, ya que el oxígeno no puede penetrar el seno metálico.
Su configuración electrónica es [Ar]4s13d5, con todos los electrones desapareados, y por lo tanto, exhibe propiedades paramagnéticas. Sin embargo, el apareamiento de los espines electrónicos puede ocurrir si se somete el metal a bajas temperaturas, adquiriendo otras propiedades, como el antiferromagnetismo.
Estructura química del cromo
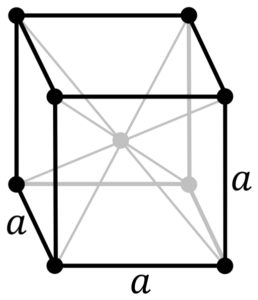
¿Cuál es la estructura del metal cromo? En su forma pura, el cromo adopta una estructura cristalina cúbica centrada en el cuerpo (cc o bcc, por sus siglas en inglés). Esto significa que el átomo de cromo se ubica en el centro de un cubo, cuyas aristas son ocupadas por otros cromos (como en la imagen superior).
Esta estructura es responsable de que el cromo posea altos puntos de fusión y de ebullición, así como una gran dureza. Los átomos de cobre solapan sus orbitales s y d para formar bandas de conducción de acuerdo a la teoría de bandas.
Así, ambas bandas se encuentran llenas a la mitad porque su configuración electrónica es [Ar]4s13d5, y como el orbital s, puede albergar dos electrones, y los orbitales d diez. Entonces, solo la mitad de las bandas formadas por sus solapamientos se encuentran ocupadas por los electrones.
Con estas dos perspectivas -la estructura cristalina y el enlace metálico-, pueden explicarse en teoría muchas de las propiedades físicas de este metal. Sin embargo, ninguna de las dos explica por qué el cromo puede tener varios estados o números de oxidación.
Para esto haría falta una profunda comprensión de la estabilidad del átomo respecto a los espines electrónicos.
Número de oxidación del cromo
Debido a que la configuración electrónica del cromo es [Ar]4s13d5 puede ganar hasta uno o dos electrones (Cr1– y Cr2–), o ir perdiéndolos para adquirir diferentes números de oxidación.
Así, si el cromo pierde un electrón, quedaría como [Ar]4s03d5; si pierde tres, [Ar]4s03d3; y si los pierde todos, [Ar], o lo que es igual, sería isoelectrónico al argón.
El cromo no pierde ni gana electrones por mero capricho: tiene que existir una especie que los done o los acepte para ir pasando de un número de oxidación a otro.
El cromo tiene los siguientes números de oxidación: -2, -1, 0, +1, +2, +3, +4, +5 y +6. De ellos el +3, Cr3+, es el más estable y por tanto, el predominante de todos; seguido del +6, Cr6+.
Cr(-2, -1 y 0)
Es improbable que el cromo gane electrones debido a que es un metal, y por tanto su naturaleza es donarlos. Sin embargo, puede coordinarse con ligandos, esto es, moléculas que interaccionan con el centro metálico mediante un enlace dativo.
Uno de los más conocidos es el monóxido de carbono (CO), el cual forma el compuesto hexacarbonilo de cromo.
Este compuesto tiene fórmula molecular Cr(CO)6, y dado que los ligandos son neutros y no aportan ninguna carga, entonces el Cr presenta un número de oxidación de 0.
También esto puede observarse en otros compuestos organometálicos como el bis(benceno)cromo. En este último, el cromo se encuentra rodeado de dos anillos bencénicos en una estructura molecular de tipo sándwich:
De estos dos compuestos organometálicos pueden surgir muchos otros de Cr(0).
Se han encontrado sales donde interaccionan con cationes sodios, lo que implica que el Cr deba poseer un número de oxidación negativo para atraer cargas positivas: Cr(-2), Na2[Cr(CO)5] y Cr(-1), Na2[Cr2(CO)10].
Cr(I) y Cr(II)
El Cr(I) o Cr1+ se produce por la oxidación de los compuestos organometálicos recién descritos. Esto se logra mediante ligandos oxidantes, como el CN o el NO, formando así, por ejemplo, el compuesto K3[Cr(CN)5NO].
Aquí el hecho de haber tres cationes K+ implica que el complejo de cromo tiene tres cargas negativas; asimismo, el ligando CN– aporta cinco cargas negativas, de manera que entre el Cr y el NO deben sumar dos cargas positivas (-5 +2= -3).
Si el NO es neutro, entonces se trata de Cr(II), pero si tiene carga positiva (NO+), es en ese caso Cr(I).
Por otra parte, los compuestos de Cr(II) son más abundantes, encontrándose entre ellos los siguientes: cloruro de cromo (II)(CrCl2), acetato cromoso (Cr2(O2CCH3)4), óxido de cromo (II)(CrO), sulfuro de cromo (II)(CrS), y otros más.
Cr(III)
De todos es el de mayor estabilidad, pues es de hecho el producto de muchas reacciones oxidantes de los iones cromatos. Quizás su estabilidad se deba a su configuración electrónica d3, en la cual tres electrones ocupan tres orbitales d de menor energía frente a los otros dos restantes más energéticos (desdoblamiento de orbitales d).
El compuesto más representativo de este número de oxidación es el óxido de cromo (III)(Cr2O3). Dependiendo de los ligandos que se coordinen a él, el complejo exhibirá un color u otro. Ejemplos de estos compuestos son: [CrCl2(H2O)4]Cl, Cr(OH)3, CrF3, [Cr(H2O)6]3+, etc.
Aunque la fórmula química no lo evidencia a primera vista, el cromo suele tener una esfera de coordinación octaédrica en sus complejos; esto es, se ubica en el centro de un octaedro en donde sus vértices se posicionan los ligandos (seis en total).
Cr(IV) y Cr(V)
Los compuestos en donde participa el Cr5+ son muy pocos, debido a la inestabilidad electrónica de dicho átomo, además de que se oxida fácilmente a Cr6+, mucho más estable al ser isoelectrónico respecto al gas noble argón.
Sin embargo, los compuestos de Cr(V) pueden sintetizarse bajo ciertas condiciones, como una alta presión. Asimismo, suelen descomponerse a temperaturas moderadas, lo que imposibilita sus posibles aplicaciones al no poseer resistencia térmica. Algunos de ellos son: CrF5 y K3[Cr(O2)4] (el O22- es el anión peróxido).
Por otra parte, el Cr4+ es relativamente más estable, pudiéndose sintetizar sus compuestos halogenados: CrF4, CrCl4 y CrBr4. No obstante, también son susceptibles a descomponerse mediante reacciones redox para producir átomos de cromo con mejores números de oxidación (como el +3 o el +6).
Cr(VI): el par cromato-dicromato
2[CrO4]2- + 2H+ (Amarillo) => [Cr2O7]2- + H2O (Anaranjado)
La ecuación anterior corresponde a la dimerización ácida de dos iones cromatos para producir dicromato. La variación del pH provoca un cambio en las interacciones en torno al centro metálico de Cr6+, evidenciándose asimismo en el color de la solución (de amarillo a anaranjado o viceversa). El dicromato consiste en un puente O3Cr-O-CrO3.
Los compuestos de Cr(VI) tienen las características de ser perjudiciales e incluso cancerígenos para el cuerpo humano y los animales.
¿Cómo? Estudios sostienen que los iones CrO42- cruzan las membranas celulares por acción de las proteínas que transportan sulfatos (ambos iones de hecho tienen tamaños similares).
Los agentes reductores dentro de las células reducen el Cr(VI) a Cr(III), el cual se acumula al coordinarse irreversiblemente a sitios específicos de las macromoléculas (como las del ADN).
Contaminada la célula por un exceso del cromo, este no puede salir debido a la falta de mecanismos que lo transporten de regreso por las membranas.
Usos del cromo
Como colorante o pigmento
El cromo presenta una amplia gama de aplicaciones, desde colorante para distintos tipos de telas, hasta el protector que embellece las piezas metálicas, en lo que se conoce como cromado, el cual puede hacerse con el metal puro, o con compuestos de Cr(III) o Cr(VI).
El fluoruro crómico (CrF3), por ejemplo, se utiliza como colorante para los paños de lana; el sulfato crómico (Cr2(SO4)3), se destina para colorear esmaltes, cerámicas, pinturas, tintas, barnices, y también sirve para cromar los metales; y el óxido crómico (Cr2O3) también encuentra uso donde se requiera su atractivo color verde.
Por lo tanto, cualquier mineral de cromo con colores intensos puede estar destinado para teñir una estructura, pero tras ello surge el hecho de si dichos compuestos son peligrosos o no para el medioambiente o para la salud de los individuos.
De hecho, sus propiedades venenosas se aprovechan para conservar la madera y otras superficies del ataque de insectos.
En el cromado o en la metalurgia
Asimismo, se agregan cantidades pequeñas de cromo al acero para fortalecerlo frente a la oxidación y para mejorar su brillo. Esto se debe a que es capaz de formar carburos grisáceos (Cr3C2) muy resistentes a la hora de reaccionar con el oxígeno del aire.
Debido a que el cromo puede pulirse hasta obtener superficies brillantes, los cromados presentan entonces diseños y colores plateados como una alternativa más económica para estos fines.
Nutricionales
Algunos debaten si puede considerarse el cromo como un elemento esencial, esto es, indispensable en la dieta diaria. Está presente en algunos alimentos en muy pequeñas concentraciones, como las hojas verdes y los tomates.
Asimismo, existen suplementos proteicos que regulan la actividad de la insulina y favorecen el crecimiento muscular, como es el caso del polinicotinato de cromo.
¿Dónde se encuentra el cromo?
El cromo se encuentra en una variedad grande de minerales y gemas, como los rubíes y las esmeraldas. El principal mineral de donde se extrae el cromo es la cromita (MCr2O4), donde M puede ser cualquier otro metal con el que esté asociado el óxido de cromo. Estas minas abundan en Suráfrica, en la India, Turquía, Finlandia, Brasil y otros países.
Cada fuente posee uno o más variantes de cromita. De esta manera, por cada M (Fe, Mg, Mn, Zn, etc.) surge un mineral de cromo distinto.
Para extraerse el metal es necesario reducir el mineral, es decir, hacer que el centro metálico de cromo gane electrones por acción de un agente reductor. Esto se hace con carbono o aluminio:
FeCr2O4 + 4C => Fe + 2Cr + 4CO
Asimismo, se encuentra la cromita (PbCrO4).
Por lo general, en cualquier mineral donde el ion Cr3+ pueda sustituir al Al3+, ambos con radios iónicos ligeramente similares, constituye una impureza que resulta en otra fuente natural de este asombroso pero nocivo metal.
Referencias
- Tenenbaum E. Chromium. Tomado de: chemistry.pomona.edu
- Wikipedia. (2018). Chromium. Tomado de: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (06 de abril de 2018). What Is the Difference Between Chrome and Chromium? Tomado de: thoughtco.com
- N.V. Mandich. (1995). Chemistry of Chromium. [PDF]. Tomado de: citeseerx.ist.psu.edu
- Chemistry LibreTexts. Chemistry of Chromium. Tomado de: chem.libretexts.org
- Saul 1. Shupack. (1991). The Chemistry of Chromium and Some Resulting Analytical Problems. Revisado de: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Chromium. Tomado de: chemistryexplained.com
