Método de Bradford: qué es, principio, reactivos, usos
El método de Bradford es un método colorimétrico empleado corrientemente para la estimación rápida de la concentración de proteínas totales en muestras biológicas de experimentación. Es utilizado en numerosos campos de la investigación biológica, médica, veterinaria, agronómica, etc.
Se conoce como “método de Bradford” porque fue descrito por primera vez por Marion Bradford en 1976, en su publicación titulada Un método rápido y sensible para la cuantificación de proteínas en cantidades de microgramos empleando el principio de unión proteína-tinte.

Desde su propuesta, este método se ha popularizado enormemente, pues es reconocidamente más sensible que otros métodos de cuantificación de proteínas (como el de Lowry y el de Biuret, por ejemplo); forma complejos más estables en el tiempo y es económico y fácil de llevar a cabo.
Además, se ha demostrado que los reactivos que utiliza tienen muy poca interferencia en las mediciones espectrofotométricas en diferentes condiciones.
Índice del artículo
El método de Bradford se basa en la cuantificación de los cambios de color en una solución debidos a la unión -en condiciones ácidas- de las moléculas proteicas de una muestra con las moléculas de un tinte especial: el azul de Coomassie Brilliant Blue G250.
Cuando este tinte se añade a una solución de proteínas, el mismo se une a dichas moléculas a través de fuerzas electrostáticas y esta reacción se evidencia como un cambio de color de marrón rojizo a azul.
Así como el cuerpo está formado por muchas células y los ácidos nucleicos (como el ADN y el ARN) están formados por nucleótidos, las proteínas están formadas por secuencias ordenadas de unas moléculas conocidas como aminoácidos.
Un aminoácido es una molécula compuesta por un átomo de carbono central al que se unen 4 grupos químicos distintos: un átomo de hidrógeno, un grupo carboxilo, un grupo amino y un grupo o cadena lateral, que le da la identidad.
Existen 20 aminoácidos que son comunes para todas las proteínas, los cuales se diferencian entre sí respecto a las propiedades de sus grupos laterales: hay aminoácidos básicos, ácidos, polares, apolares, cíclicos, aromáticos, etc.
Las suma de las características de estos aminoácidos y el orden en el que se unen para formar la estructura proteica le otorga a cada proteína una serie de características fisicoquímicas particulares, bien sea respecto a su carga, su masa, su hidrofobicidad, entre otras.
El método de Bradford, entonces, cuantifica la presencia de residuos aminoacídicos de características básicas en muestras biológicas, particularmente de aminoácidos como la arginina, la lisina y la histidina, que son los que se acomplejan más fácilmente con el azul de Coomassie.
Los cambios de color son cuantificados como variaciones en la absorbancia de las muestras, la cual es medida empleando un espectrofotómetro ajustado a una longitud de onda de 595 nm.
Se conoce también como densidad óptica y define la cantidad de luz que es absorbida por una solución. Dicha absorción depende de la longitud de onda de la luz que se emplea para irradiar la solución, pues no todas las moléculas son capaces de absorber a la misma longitud de onda.
Este fenómeno fue resumido en una ley conocida como la Ley de Beer-Lambert, que establece la relación entre la disminución de la cantidad de luz que pasa a través de una sustancia y las propiedades de dicha sustancia.
Por ejemplo, cuando una luz es transmitida a través de una solución se tienen dos medidas de intensidad: una intensidad incidente (antes de atravesar la solución) y una intensidad transmitida (generalmente menor, que corresponde a la fracción de luz que no fue absorbida por la solución).
La relación entre ambos valores es lo que se conoce como tramitancia y tiene valores entre 0 y 1 o se expresa en términos porcentuales.
La absorbancia está relacionada con la tramitancia de forma logarítmica, y la ley de Beer-Lambert propone una relación lineal entre la absorbancia de una solución y su concentración, su coeficiente de extinción molar y el coeficiente óptico de la solución; la ecuación matemática que describe esta ley es la siguiente:
A (absorbancia) = ε (coeficiente de extinción molar) c (concentración) l (longitud del paso de luz)
La concentración de una solución se calcula despejando dicha incógnita de la ecuación y realizando los cálculos pertinentes (c = A/εl)
Es un dispositivo que se emplea para cuantificar la cantidad de luz (en función de la longitud de onda) que absorben las moléculas en una solución o, en otras palabras, la cantidad de luz que dejan pasar.
Los espectrofotómetros funcionan emitiendo un haz de luz (visible o ultravioleta) que pasa a través de un prisma (o un dispositivo conocido como monocromador de red de difracción) que la descompone en las distintas longitudes de onda que la conforman, permitiendo “seleccionar” una longitud en particular.
Esa luz se hace pasar a través de un tubo especial que contiene la muestra que se analiza y posteriormente alcanza un detector que percibe la cantidad de luz que se transmite desde dicha muestra (la que no fue absorbida) lo que puede observarse después gracias a un “interpretador” que tiene una interfaz gráfica.
El reactivo más importante de este método es, sin duda, el tinte empleado para “marcar” las proteínas en la muestra. Bradford propuso su empleo debido a que este tinte existe en dos formas: una roja y otra azul. La forma roja se convierte en la forma azul una vez que el tinte se une a una proteína, formando un complejo.
El complejo azul de Coomassie-proteína tiene un coeficiente de extinción molar muy alto, lo que resulta en una mayor sensibilidad para la cuantificación de la concentración proteica en las muestras analizadas.
Aunque la solución que se emplea para este método de cuantificación generalmente es comercializada en envases cerrados, ya preparada -el “reactivo de Bradford”-, los principales reactivos que se emplean son:
– Azul de Coomassie Brilliant Blue G50 (0.01% w/v)
– Ácido fosfórico (8.5 % w/v)
– Etanol (4.7% w/v)
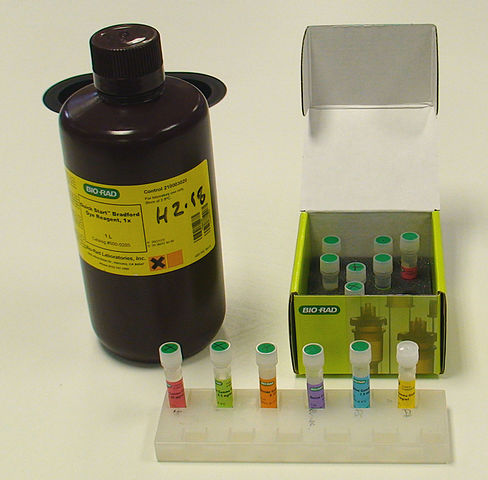
Como en cualquier método y protocolo de cuantificación de proteínas por métodos espectrofotométricos, es necesario tener una proteína “patrón” o “estándar” con el fin de realizar una curva de calibración para determinar los valores de absorbancia relativos a distintas concentraciones de proteína; generalmente se emplea albúmina de suero bovino.
El método consiste en mezclar determinados volúmenes de las muestras problema con determinados volúmenes del reactivo de Bradford; esperar un par de minutos a que ocurra la interacción tinte-proteína y se evidencie el cambio de color y posteriormente medir y registrar los valores de absorbancia para realizar los cálculos posteriores.
El método de Bradford es uno de los métodos de cuantificación o estimación de la concentración de proteínas más utilizados en el mundo, principalmente debido a su bajo costo, a la rapidez con la que se obtienen los resultados, a la gran estabilidad entre la proteína y el tinte utilizado, a su reproducibilidad y a la mínima interferencia que tienen los componentes de los reactivos empleados durante la medición.
El método es empleado en cientos de aplicaciones científicas diferentes para la determinación de proteínas en distintos contextos: fisiológicos, citológicos, inmunológicos, clínicos, industriales (particularmente en la industria alimenticia), etc.
Experimentalmente, este método es muy útil para:
- Monitorear la cantidad de proteína contenida en los volúmenes que se obtienen progresivamente de una columna cromatográfica (en columnas de afinidad, de intercambio iónico, de absorción, de filtración en gel, entre otras) i.e. analizar fracciones de protocolos de purificación de proteínas.
- Monitorear la cantidad de proteína que se carga en un gel para electroforesis.
- Estimar la cantidad de proteína obtenida en un sistema de sobreexpresión.
- Bonjoch, N. P., & Tamayo, P. R. (2001). Protein content quantification by Bradford method. In Handbook of plant ecophysiology techniques (pp. 283-295). Springer, Dordrecht.
- Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical biochemistry, 72(1-2), 248-254.
- Kielkopf, C. L., Bauer, W., & Urbatsch, I. L. (2020). Bradford assay for determining protein concentration. Cold Spring Harbor Protocols, 2020(4), pdb-prot102269.
- Sapan, C. V., Lundblad, R. L., & Price, N. C. (1999). Colorimetric protein assay techniques. Biotechnology and applied Biochemistry, 29(2), 99-108.
- Walker, J. M. (Ed.). (1996). The protein protocols handbook (Vol. 1996). Springer Science & Business Media.
