Metoxietano: estructura, propiedades, obtención, usos, riesgos
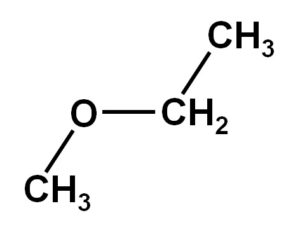
El metoxietano es un compuesto orgánico de la familia de los éteres o alcóxidos. Su fórmula química es CH3OCH2CH3. También es denominado metil etil éter o etil metil éter. Es un compuesto gaseoso a temperatura ambiente y su molécula presenta dos grupos metilo –CH3, uno unido directamente al oxígeno y el otro perteneciente al etilo –CH2CH3.
El metoxietano es un gas incoloro, soluble en agua y miscible con éter y alcohol etílico. Por ser un éter es un compuesto poco reactivo, sin embargo, puede reaccionar a altas temperaturas con algunos ácidos concentrados.
Generalmente se obtiene mediante la denominada síntesis de Williamson, que comprende la utilización de un alcóxido de sodio y un yoduro de alquilo. A su vez, su descomposición ha sido estudiada bajo varias condiciones.
El metoxietano es empleado en laboratorios de investigación con diversos objetivos, por ejemplo, en el estudio de nanomateriales semiconductores o en la observación de la materia interestelar en constelaciones y grandes nubes moleculares del universo.
De hecho, gracias a telescopios muy sensibles (interferómetros) ha sido detectado en ciertos lugares del espacio interestelar.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades físicas
- 4 Propiedades químicas
- 5 Obtención
- 6 Ubicación en el universo
- 7 Usos del metoxietano
- 8 Riesgos
- 9 Referencias
El compuesto metoxietano posee un grupo metilo –CH3 y un grupo etilo –CH2CH3 ambos unidos a un oxígeno.
Como puede observarse, en esta molécula hay dos grupos metilo, uno unido al oxígeno CH3-O y el otro perteneciente al etilo –CH2–CH3.
En el estado fundamental o de menor energía el grupo metilo del –CH2–CH3 se encuentra en posición trans con respecto al metilo unido al oxígeno, es decir, en un lugar diametralmente opuesto, tomando como referencia el enlace CH2–O. Por esto a veces se le denomina trans-etil metil éter.
Esta molécula puede experimentar torsión en el enlace CH2–O, lo que ubica al metilo en posición espacial diferente a la trans , los grupos metilo -CH3 quedan muy cercanos el uno del otro y esta torsión genera una transición de energía detectable por instrumentos sensibles.
– Metoxietano.
– Metil etil éter.
– trans-Etil metil éter (principalmente en literatura de habla inglesa, traducción del inglés trans–ethyl methyl ether).
Gas incoloro
60,096 g/mol
-113,0 ºC
7,4 ºC
1,7 ºC (método de copa cerrada).
190 ºC
0,7251 a 0 ºC/0 ºC (Es menos denso que el agua pero más pesado que el aire).
1,3420 a 4 ºC
Soluble en agua: 0,83 moles/L
Soluble en acetona. Miscible con alcohol etílico y éter etílico.
El metoxietano es un éter por lo que es relativamente poco reactivo. La unión carbono-oxígeno-carbono C–O–C es muy estable frente a las bases, agentes oxidantes y reductores. Solamente se produce su degradación por ácidos, pero esta solo procede en condiciones vigorosas, esto es, con ácidos concentrados y temperaturas elevadas.
Sin embargo, tiende a oxidarse en presencia de aire formando peróxidos inestables. Si se exponen los recipientes que lo contienen al calor o fuego, los contenedores explotan violentamente.
Cuando se somete el metoxietano a calentamiento entre 450 y 550 ºC se descompone a acetaldehído, etano y metano. Esta reacción está catalizada por la presencia de yoduro de etilo, el cual generalmente está presente en las muestras de metoxietano de laboratorio debido a que se emplea en su obtención.
El metoxietano irradiado con una lámpara de vapor de mercurio (longitud de onda de 2537 Å) se descompone generando una amplia variedad de compuestos entre los que destacan: hidrógeno, 2,3-dimetoxibutano, 1-etoxi-2-metoxipropano y metil vinil éter.
Los productos finales dependen del tiempo de irradiación de la muestra, pues al continuar la irradiación los que se forman inicialmente luego originan nuevos compuestos.
Al prolongar el tiempo de irradiación también se pueden formar: propano, metanol, etanol, acetona, 2-butanona, monóxido de carbono, etil-n-propil éter y metil-sec-butil éter.
Por ser un éter no-simétrico el metoxietano se puede obtener por la reacción entre el metóxido de sodio CH3ONa y el yoduro de etilo CH3CH2I. Este tipo de reacciones se llama síntesis de Williamson.
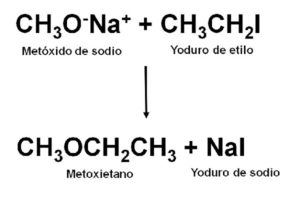
Una vez realizada la reacción, la mezcla se destila para obtener el éter.
También puede obtenerse utilizando el etóxido de sodio CH3CH2ONa y el sulfato de metilo (CH3)2SO4.
El trans-etil metil éter ha sido detectado en el medio interestelar en regiones como la constelación de Orión KL y en la nube molecular gigante W51e2.

La detección de este compuesto en el espacio interestelar junto con el análisis de su abundancia está siendo de ayuda para la construcción de los modelos de la química interestelar.
El metoxietano o metil etil éter se emplea mayormente en experiencias de laboratorio para investigaciones científicas.
Por ser una molécula orgánica con rotaciones internas, el metoxietano es un compuesto químico de interés para estudios de la materia interestelar.
Las rotaciones internas de sus grupos metilo producen transiciones de energía en la región de las microondas.
Por ello, pueden ser detectadas por telescopios altamente sensibles como el Gran Conjunto Milimétrico/submilimétrico de Atacama, o ALMA (siglas del inglés Atacama Large Millimeter/submillimeter Array).

Gracias a su rotación interna y a los grandes observatorios espaciales el trans-metil etil éter ha sido hallado en la constelación de Orión y en la nube molecular gigante W51e2.
Algunos investigadores observaron la formación del metoxietano o metil etil éter cuando se irradia con electrones una mezcla de etileno CH2=CH2 y metanol CH3OH.
El mecanismo de la reacción pasa por la formación del radical CH3O•, el cual ataca el doble enlace rico en electrones del CH2=CH2. El aducto resultante CH3-O-CH2-CH2• captura un hidrógeno de un CH3OH y forma el metil etil éter CH3-O-CH2-CH3.
El estudio de este tipo de reacciones inducidas por la irradiación de electrones es de utilidad en el campo de la bioquímica pues se ha determinado que pueden producir daños en el ADN, o en el campo de la química organometálica pues favorece la formación de nanoestructuras.
Adicionalmente, se conoce que se producen grandes cantidades de electrones secundarios cuando la radiación electromagnética o de partículas interactúa con la materia condensada en el espacio.
Por lo tanto, se estima que estos electrones pueden iniciar transformaciones químicas en la materia del polvo interestelar. De ahí la importancia de estudiar el metil etil éter en estas reacciones.
Mediante métodos de cálculo computacionales algunos científicos encontraron que el metoxietano o metil etil éter puede ser adsorbido por grafeno dopado con galio (Ga) (notar que adsorción es diferente a absorción).
El grafeno es un nanomaterial formado por átomos de carbono que se disponen formando un patrón hexagonal.

La adsorción del metoxietano sobre el grafeno dopado ocurre por la interacción entre el oxígeno del éter y el átomo de galio que se encuentra sobre la superficie del nanomaterial. Debido a esta adsorción se produce una transferencia de carga neta desde el éter hacia el galio.
Luego de la adsorción de metil etil éter y debido a esa transferencia de carga, el grafeno dopado con galio presenta propiedades de semiconductor tipo-p.
El metoxietano es altamente inflamable.
Al permanecer en contacto con aire tiene tendencia a formar peróxidos inestables y explosivos.
- U.S. National Library of Medicine. (2019). Ethyl Methyl Ether. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Irvine W.M. (2019) Ethyl Methyl Ether (C2H5OCH3). In: Gargaud M. et al. (eds). Encyclopedia of Astrobiology. Springer, Berlin, Heidelberg. Recuperado de link.springer.com.
- Tercero, B. et al. (2015). Searching for trans ethyl methyl ether in Orion KL. Astronomy & Astrophysics. 582, L1 (2015). Recuperado de ncbi.nlm.nih.gov.
- Filseth, S.V. (1969). The Mercury 6(3P1) Photosensitized Decomposition of Methyl Ethyl Ether. The Journal of Physical Chemistry. Volume 73, Number 4, April 1969, 793-797. Recuperado de pubs.acs.org.
- Casanova, J.Jr. (1963). Student Preparation and Manipulation of a Gas-Methyl Ethyl Ether. Journal of Chemical Education. Volume 40, Number 1, January 1963. Recuperado de pubs.acs.org.
- Ure, W. and Young, J.T. (1933a). On the mechanism of gaseous reactions. I. The thermal decomposition of Methyl Ethyl Ether. The Journal of Physical Chemistry, Vol. XXXVII, No.9: 1169-1182. Recuperado de pubs.acs.org.
- Ure, W. and Young, J.T. (1933b). On the mechanism of gaseous reactions. II. Homogeneous Catalysis in the Decomposition of Methyl Ethyl Ether. The Journal of Physical Chemistry, 37, 9, 1183-1190. Recuperado de pubs.acs.org.
- Shokuhi Rad, A. et al. (2017). DFT Study on the adsorption of diethyl, ethyl methyl, and dimethyl ethers on the surface of Gallium doped graphene. Applied Surface Science. Volume 401, 15 April 2017, pages 156-161. Recuperado de sciencedirect.com.
- Schmidt, F. et al. (2019). Electron-Induced Formation of Ethyl Methyl Ether in Condensed Mixtures of Methanol and Ethylene. J. Phys. Chem. A 2019, 123, 1, 37-47. Recuperado de pubs.acs.org.
