Pepsinógeno: estructura, funciones, tipos, síntesis
El pepsinógeno es el zimógeno de la pepsina, una de las principales enzimas hidrolíticas encargadas de realizar la digestión de proteínas en el estómago de mamíferos. Los zimógenos o proenzimas son precursores enzimáticos inactivos, es decir, son incapaces de catalizar las reacciones llevadas a cabo por sus formas activas.
Su activación, depende de cambios en la estructura tridimensional de la proteína que dan lugar a la formación de un sitio activo funcional. Estos cambios, en la mayoría de los casos, coinciden con la ruptura proteolítica de un segmento de la proteína.
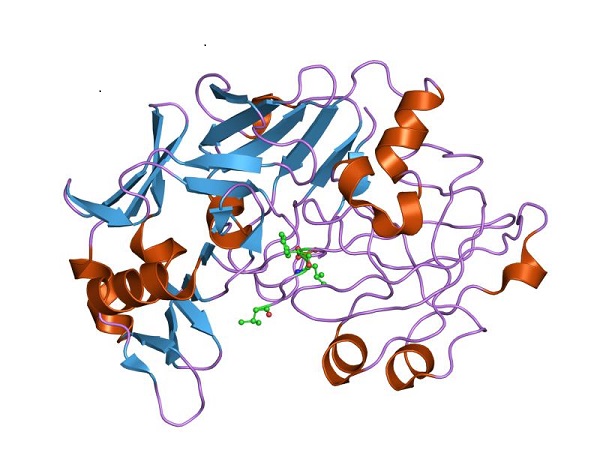
Por tanto, el pepsinógeno debe experimentar cambios estructurales para adquirir la actividad peptidasa requerida y favorecer la digestión de proteínas en el estómago, luego de la ingesta de alimentos.
Índice del artículo
El pepsinógeno es una proteína de 371 aminoácidos perteneciente a la gran familia de proteinasas aspárticas, caracterizadas por presentar residuos de ácido aspártico en su centro activo.
Su estructura cuaternaria se determinó por primera vez para la proteína expresada en cerdos mediante la técnica de cristalografía de rayos X. El resultado fue similar a la que exhibe la forma madura u activa de la proteína, la pepsina.
Así pues, la única diferencia encontrada es la presencia en el pepsinógeno de un péptido de 44 aminoácidos que se pliega sobre la hendidura del sitio activo. En esta posición, obstaculiza la interacción de esta proteasa con las proteínas a ser degradadas.
Este péptido que se clivará para dar lugar a la enzima activa, se encuentra ubicado en el extremo amino terminal de la proteína.
Dado que funciona solo como un tapón, la incapacidad del pepsinógeno de degradar proteínas no se debe a deformaciones estructurales del centro activo. Por el contrario, este permanece con la misma conformación en ambas formas de la enzima.
En este sentido, vale la pena destacar que la estructura cristal del pepsinógeno constituye un modelo aproximado de la estructura de otros zimógenos pertenecientes a la gran familia de proteinasas aspárticas.
Al principio de la vida, la pepsina (forma activa del pepsinógeno) es importante para la digestión de la leche. Posteriormente, su función es degradar las proteínas de la dieta en sus constituyentes (los aminoácidos) a fin de facilitar su fácil absorción.
El pepsinógeno es sintetizado por las células principales y las células fúndicas de la mucosa gástrica. Posteriormente, se almacena en vesículas secretoras que permanecen en el citoplasma de estas células hasta el momento en que se requiera su liberación.
Por tanto, la secreción de este zimógeno es un proceso que se encuentra regulado. Su liberación de las vesículas, residentes en el citosol a través de exocitosis, requiere de estímulos hormonales y neurales. El incremento en los niveles de las enzimas gástricas secretina y gastrina, así como, de acetilcolina, colecistoquinina, factor de crecimiento epidérmico y de óxido nítrico estimulan su síntesis y secreción.
Adicionalmente, experimentos realizados con células AtT20, una línea celular comúnmente empleada en el estudio de vías de secreción en mamíferos, han demostrado que un incremento de AMP cíclico también es capaz de inducir dicha secreción.
Además de su normal secreción a nivel estomacal, una cantidad relativamente baja de pepsinógeno ha sido detectada tanto en sangre como en orina, razón por la que ha sido denominado uropepsinógeno.
El origen del uropepsinógeno, así como la función que puede desempeñar en ambas localizaciones, permanece sin ser determinada. Sin embargo, su ausencia en pacientes a los cuales se les ha extirpado de manera total el estómago parece indicar que su origen es igualmente estomacal.
Dos tipos principales de pepsinógeno han sido descritos hasta ahora: el pepsinógeno I y el pepsinógeno II. Ambos tipos no presentan diferencias en su actividad catalítica y son igualmente activados por hidrólisis proteolítica dependiente de ácido clorhídrico.
El pepsinógeno I es sintetizado y segregado tanto por las células principales como por las células fúndicas de la mucosa gástrica. Por tanto, su secreción disminuye en pacientes con gastritis crónica atrófica, una enfermedad estomacal caracterizada por la desaparición total de las glándulas gástricas.
A diferencia de este último, el pepsinógeno II (PGII) es sintetizado por prácticamente todas las células que forman parte de la mucosa gástrica, pero de manera más prominente por las de la mucosa antral y las que integran las glándulas de Brünner presentes en el duodeno.
En pacientes con gastritis crónica atrófica, este tipo de pepsinógeno compensa la disminución en la secreción de pepsinógeno I.
La existencia de estos dos tipos de pepsinógeno, que solo se diferencian por ser secretados por células diferentes, podría parecer redundante. No obstante, puede ser una adaptación evolutiva para garantizar la síntesis de pepsina siempre que sea necesario.
El pepsinógeno adquiere actividad catalítica al ser transformado en pepsina, producto de la eliminación del péptido de 44 aminoácidos presente en la cavidad del sitio activo.
Su funcionamiento óptimo depende de valores bajos de pH comprendidos en el rango de 1,5 a 2. En condiciones fisiológicas, estos valores son mantenidos por la secreción de ácido clorhídrico en los canales intracelulares.
La digestión ácida a nivel del estómago no tiene lugar en todos los animales, siendo un ejemplo de ello son insectos, quienes carecen de pepsinógeno. No obstante, los vertebrados que poseen estómago si disponen de actividad péptica.
El pepsinógeno, el cual se encuentra almacenado en las vesículas secretoras de las células principales, es liberado al ducto gástrico cuando es necesario. Una vez que llega a la luz estomacal, se convierte en pepsina producto del ambiente ácido y esta activa más moléculas de pepsinógeno.
Por acción de las fibras nerviosas intrínsecas y la estimulación extrínseca vagal, la producción de pepsinógeno es estimulada, así como también la de HCl, gastrina e histamina. Por otro lado, la histamina y la gastrina estimulan a las células parietales a secretar HCl.
La pepsina, como toda endopeptidasa, actúa sobre enlaces específicos entre los aminoácidos de las proteínas para generar péptidos de menor tamaño.
En otras palabras; hidroliza los enlaces peptídicos internos de una proteína. Su acción es más efectiva en los enlaces peptídicos próximos a los aminoácidos aromáticos (fenilalanina, tirosina). A diferencia de su zimógeno precursor, los cambios adaptativos de la pepsina en valores de pH superiores a 6 producen descensos irreversibles de la actividad catalítica.
- Bryksa BC, Tanaka T, Yada RY. N-terminal modification increases the neutral-pH stability of pepsin. Biochemistry. 2003; 42:13331-13338.
- Foltmann B, Pedreson VB. Comparison of the primary structures of acidic proteases and their zymogens. Adv Exp Med Biol. 1977; 95:3-22.
- Guyton A, Hall J. (2006). Textbook of Medical Phisiology. (11º ed.). USA: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, Principios de Medicina Interna. (16º ed.). México: McGrawHill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Severe atrophic gastritis with Helicobacter pylori infection and gastric cancer. Gastric Cancer. 1998; 1: 118-124.
- Lin Y, Fused M, Lin X, Hartsuck JA, Tang J. pH dependence of kinetic parameters of pepsin, Rhizopuspepsin and their active-site hydrogen bonds mutants. J Biol chem. 1992; 267:18413-18418.
- Mangeat P. Acid secretion and membrane reorganitation in single gastric parietal cell in primary culture. Biology cell. 1990; 69:223-257.
- Prozialeck J, Wershil BK. (2017). Desarrollo de la función secretora gástrica. Fetal and Neonatal Physiology (Quinta edición). Volumen 1, págs 881-888.
- Schubert ML. Gastric secretion. Current Opin Gastroent 2005; 21:633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James MNG. The molecular and crystal structures of monoclinic porcine pepsin refined at 1.8 Å resolution. J Mol Biol. 1990; 214:143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Elder JB. The epidemiology of low serum pepsinogen A levels and an international association with gastric cancer rates. Gastroenterology. 1994; 107:1335-1344.
- Wolfe MM, Soll AH. The physiology of gastric acid secretion. N Engl J Med 1998; 319:1707.
