Agar harina de maíz: fundamento, preparación y uso
El agar harina de maíz es un medio de cultivo sólido, de bajo poder nutricional, útil para el sub-cultivo de ciertos hongos y para la demostración de clamidosporos en cepas del complejo Candida albicans. En inglés se conoce como Corn Meal Agar.
El medio harina de maíz convencional tiene una composición muy simple, contiene harina de maíz, agar-agar y agua. Por su bajo nivel nutricional es ideal para utilizarlo en el mantenimiento de cepas fúngicas por moderados períodos de tiempo, en especial de hongos negros.
La esporulación del complejo Candida albicans se ve favorecida en este medio, si se le adiciona 1% de Tween 80 durante la preparación del agar. La formación de clamidosporas es característico de esta especie y prácticamente la única que afecta al ser humano.
Hay otras especies que forman clamidosporas, pero es poco probable que afecten al humano, como por ejemplo Candida australis, presente en el excremento de pingüinos, o C. clausenii, que es un saprófito rara vez encontrado. Así mismo, excepcionalmente las especies C. stellatoidea y C. tropicalis podrían formarlas.
Por otra parte, la adición de glucosa al medio harina de maíz favorece la formación de pigmentos en cepas de Trichophytom rubrum.
Es importante destacar que existen hongos que no forman hifas, ni pseudohifas en agar harina de maíz, como por ejemplo Cryptococcus neoformans, diferenciándose de otros géneros.
El agar harina de maíz puede prepararse caseramente en el laboratorio o también se pueden utilizar medios comerciales.
Índice del artículo
La harina de maíz es el sustrato, el agar es el agente solidificante y el agua es el disolvente.
El agar harina de maíz puede ser suplementado con tween 80 (polyester 80 de sorbitan monooleato o polisorbato). Este compuesto disminuye la tensión superficial del medio por su poder emulsificante.
Además crea un ambiente hostil que inhibe la multiplicación celular exagerada y estimula el crecimiento de hifas, favoreciendo también la producción de clamidosporas; estas últimas consideradas estructuras de resistencia. Esta estructura ayuda en la identificación de la especie de Candida albicans.
Por su parte, la glucosa en este medio aumenta la capacidad de formación de pigmentos de algunos hongos.
Cabe destacar que el medio harina de maíz con glucosa no sirve para la demostración de clamidosporas en complejo Candida albicans.
Preparación casera del agar harina de maíz
Pesar 47 gr de harina de maíz amarillo y disolver en 500 ml de agua destilada. Calentar a 60 ºC, mientras se agita la preparación en un período aproximado de 1 hora. Luego filtrar a través de un trozo de gasa y algodón, opcionalmente se puede volver a filtrar pasando la preparación por un papel de filtro Whatman Nº 2.
Completar el volumen a 1000 ml con agua destilada. Adicionar 17 gr de agar-agar, calentar hasta disolver. Autoclavar por 15 minutos a 121 ºC.
Servir en placas de Petri estériles. Guardar en nevera.
El color del medio preparado es blanquecino con aspecto grumoso.
Si se desea preparar harina de maíz con glucosa a la preparación antes descrita adicionar 10 gr de glucosa.
Pesar 17 gr del medio deshidratado y disolver en 1 litro de agua destilada. Se puede calentar la mezcla, agitando suavemente para disolver completamente. Esterilizar en autoclave a 121 ºC, a 15 lb, por 15 minutos.
Verter en placas de Petri estériles. Dejar solidificar. Invertir y guardar en nevera hasta su uso. Atemperar antes de usar.
El pH debe quedar en 6,0 ± 0,2 a 25 ºC.
Para cumplir con la norma ISO 18416 se debe preparar el agar harina de maíz de la siguiente manera:
Pesar 65 gr por litro y adicionar 10 ml de Tween 80. Calentar y hervir por pocos minutos hasta disolver, teniendo cuidado de no sobrecalentar demasiado. Esterilizar a 121 ºC por 15 minutos.
Para mejorar el poder cromogénico de las colonias de Trichophyton rubrum y diferenciarlas de T. mentagrophytes, se puede adicionar 0,2% de glucosa a la fórmula original. No necesita tener Tween 80, ya que la glucosa inhibe la formación de clamidosporas.
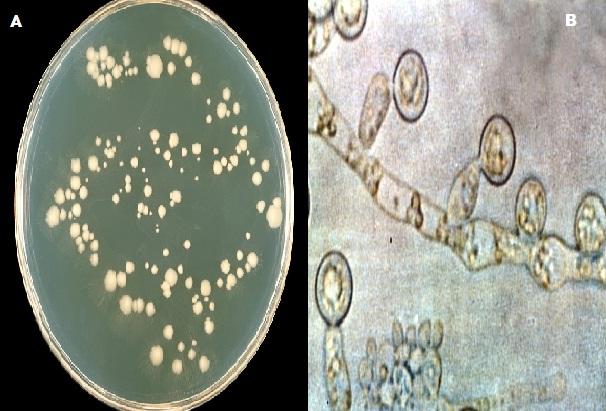
Principalmente el uso del agar harina de maíz está destinado al estudio de cepas de Candida, ayudando a su identificación a través de la observación característica de las clamidosporas en la especie albicans. Es decir, el uso de este agar sirve como método auxiliar de identificación de estas levaduras.
En este agar pueden desarrollarse tanto especies saprófitas como patógenas, pero cada una forma estructuras miceliales características. Por ejemplo, especies del género Torulopsis no producen micelio y se reproducen solo por blastoconidios.
Así mismo, las especies Trichosporon y Geotrichum producen artroconidias en agar harina de maíz y algunas veces es difícil de distinguir entre una y otra.
Los artroconidios del género Geotrichum producen una extensión de las hifas semejando un palo de hockey.
También la producción de pigmentos utilizando el agar harina de maíz suplementado con glucosa es útil en la identificación de Trichophytom rubrum.
En el agar harina de maíz se subcultivan las colonias sospechosas de Candida obtenidas en el medio de cultivo primario -agar Sabouraud-, provenientes de muestras clínicas, cosméticos, suelos, entre otros. El medio se siembra y se incuba a 22 ºC por 24 a 48 horas. Puede alargarse el tiempo de incubación si es necesario.
Para este fin el agar harina de maíz con Tween 80 debe inocularse utilizando la técnica de Dalmau. Este método consiste en tomar con el asa de platino una porción de la colonia sospechosa y hacer tres cortes paralelos en el medio manteniendo el asa a 45º. Los cortes deben estar separados a una distancia de 1 cm entre uno y otro.
Posteriormente se coloca un cubre-objeto previamente flameado sobre las estrías sembradas, de tal manera que quede la mitad cubierta y la otra descubierta.
Incubar las placas sembradas a 30 °C durante 48-72 h y luego examinar al microscopio a través del cubre-objetos.
Para el mantenimiento de cepas las placas sembradas y crecidas se guardan en nevera (4 a 8 ºC). De esta forma pueden durar varias semanas y ser utilizadas con fines de docencia o investigación.
Para el control de esterilidad se incuba una placa sin inocular a temperatura ambiente, se espera que no haya crecimiento, ni cambio de color.
Para el control de calidad se pueden sembrar cepas conocidas tales como: Staphylococcus aureus, ATCC 6538, Escherichia coli ATCC 25922, Aspergillus niger ATCC 16404, Candida albicans ATCC 1023, Saccharomyces cerevisiae ATCC 9763.
Los resultados esperados son inhibición parcial para S. aureus y E. coli. En tanto que se espera un crecimiento satisfactorio en el resto de las cepas.
Aspergillus niger crece con colonias de color negro y esporuladas en un tiempo aproximado de 5 días de incubación.
Candida albicans colonias levaduriformes con producción de clamidosporas.
Saccharomyces cerevisiae producen células levaduriformes grandes.
En el fondo de la placa se forma un precipitado amarillo que no debe ser confundido con colonias.
- Laboratorios Neogen. Corn Meal Agar. Disponible en: foodsafety.neogen.com.
- Microkit Medios de Cultivo. Corn Meal Agar. Disponible en: medioscultivo.com.
- Linares M, Solís F. Guía Identificación de levaduras. Disponible en: http://www.guia.revibero.
- Urcia F, Guevara M. Rev. Perú Med.Exp. Salud Pública, 2002; 19 (4): 206-208. Disponible en: Scielo.com
- Casas-Rincón G. Micología General. 1994. 2° Ed. Universidad Central de Venezuela, Ediciones de biblioteca. Venezuela, Caracas.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnóstico Microbiológico. 5ta ed. Editorial Panamericana S.A. Argentina.
- Castillo E. Estudio comparativo de algunos métodos macro y microscópicos para el aislamiento y reconocimiento del género Candida. Rev. Colombiana de Ciencias Químico farmacéuticas. 1970; 3 (1):33-57. Disponible en: ciencias.unal.edu.co
