Ley de Boyle-Mariotte: historia, expresión, ejemplos
La ley de Boyle-Mariotte es aquella que expresa la relación entre la presión ejercida por o sobre un gas, y el volumen que ocupa este; manteniendo constante tanto la temperatura del gas, así como su cantidad (número de moles).
Esta ley, junto a la de Charles, Gay-Lussac, Charles y Avogadro, describe el comportamiento de un gas ideal; específicamente, en un recipiente cerrado sometido a cambios de volumen ejercidos por una fuerza mecánica.
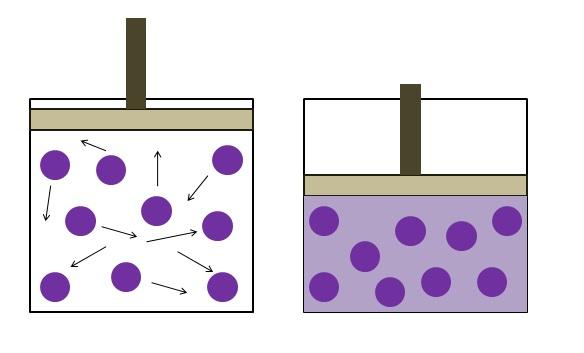
La imagen superior resume de manera breve la ley de Boyle-Mariotte.
Los puntos morados representas moléculas o átomos de gas, los cuales colisionan con las paredes internas del recipiente (izquierda). Al disminuir el espacio o volumen disponible del recipiente ocupado por este gas, se incrementan las colisiones, lo cual se traduce en un aumento de la presión (derecha).
Esto demuestra que la presión P y volumen V del gas, son inversamente proporcionales si el recipiente está cerrado herméticamente; de lo contrario, una mayor presión sería igual a una mayor dilatación del recipiente.
Si se realizara una gráfica V en contra P, con los datos de V y P en los ejes Y y X, respectivamente, se observaría una curva asintótica. Mientras menor sea V, mayor será el incremento en P; es decir, la curva se prolongará hacia valores altos de P en el eje X.
Por supuesto, la temperatura se mantiene constante; pero, si se realizara el mismo experimento a distintas temperaturas, las posiciones relativas de estas curvas V vs P cambiarían en el eje cartesiano. El cambio sería aún más evidente si se graficara en un eje de tres dimensiones, con T constante en el eje Z.
Índice del artículo
- 1 Historia de la ley de Boyle
- 2 ¿En qué consiste esta ley?
- 3 Expresión matemática
- 4 ¿Para qué sirve? ¿Qué problemas resuelve la ley de Boyle?
- 5 Ejemplos (experimentos)
- 6 Referencias
Desde que el científico Galileo Galilei expresase su creencia en la existencia del vacío (1638), los científicos comenzaron a estudiar las propiedades del aire y de los vacíos parciales.
El químico angloirlandés, Robert Boyle, inició su estudio de las propiedades del aire en 1638 al enterarse de que Otto von Guericke, un ingeniero y físico alemán, había construido una bomba de aire.
Para realizar sus estudios de la presión del aire, Boyle utilizó un tubo de vidrio en forma de “J”, cuya construcción fue atribuida a Robert Hooke, un ayudante de Boyle. El extremo del brazo corto estaba sellado, mientras que el extremo del brazo largo del tubo estaba abierto para colocar el mercurio.
Desde un principio, Boyle deseaba estudiar la elasticidad del aire, cualitativa y cuantitativamente. Al verter mercurio a través del extremo abierto del tubo en forma de “J”, Boyle dedujo que el aire en el brazo corto del tubo se contraía bajo la presión del mercurio.
Resultados
Mientras mayor era la cantidad de mercurio agregado al tubo, mayor era la presión ejercida sobre el aire y menor era su volumen. Boyle obtuvo un gráfico de tipo exponencial negativo del volumen del aire en función de la presión.
Mientras, si se grafica el volumen del aire contra el inverso de la presión, se tiene una línea recta de pendiente positiva.
En 1662, Boyle publicó la primera ley física que venía dada en forma de ecuación, la cual señalaba la dependencia funcional de dos variables. En este caso, la presión y el volumen.
Boyle señaló que existía una relación inversa entre la presión ejercida sobre un gas y el volumen que ocupaba ese gas, siendo esta relación relativamente cierta para los gases reales. La mayoría de los gases se comportan como gases ideales a presiones y temperaturas moderadas.
Al producirse presiones más elevadas y temperaturas más bajas, las desviaciones del comportamiento de los gases reales de los ideales se hicieron más notables.
El físico francés Edme Mariotte (1620-1684) descubrió en forma independiente la misma ley en 1679. Pero tuvo el mérito de evidenciar que el volumen varía con la temperatura. Por eso se llama Ley de Mariotte o Ley de Boyle y Mariotte.
Daniel Bernoulli (1737) fortaleció La Ley de Boyle al señalar que la presión de un gas es producida por los impactos de las partículas del gas sobre las paredes del recipiente que lo contienen.
En 1845, John Waterston publicó un artículo científico, en el cual enfoca los principios principales de la teoría cinética de los gases.
Posteriormente, Rudolf Clausius, James Maxwell y Ludqwig Boltzmann consolidaron la teoría cinética de los gases, que relaciona la presión ejercida por un gas con la velocidad de las partículas del gas en movimiento.
Mientras menor sea el volumen del recipiente que contiene un gas, mayor será la frecuencia de los impactos de las partículas que lo forman contra las paredes del recipiente; y por lo tanto, mayor será la presión ejercida por el gas.
Los experimentos realizados por Boyle, señalan que existe una relación inversa entre el volumen ocupado por un gas y la presión ejercida sobre él. Sin embargo, la relación señalada no es totalmente lineal, tal como lo indica un gráfico de variación del volumen en función de la presión atribuido a Boyle.
En la Ley de Boyle se señala que el volumen ocupado por un gas es inversamente proporcional a la presión. También se indica que el producto de la presión de un gas por su volumen es constante.
Para llegar a la expresión matemática de la ley de Boyle-Mariotte se parte desde:
V ∝ 1/P
Donde indica que el volumen ocupado por un gas es inversamente proporcional a su presión. Sin embargo, existe una constante que dictamina qué tan inversamente proporcional es dicha relación.
V = k/P
Donde k es la constante de proporcionalidad. Despejando k se tiene:
VP = k
El producto de la presión de un gas por su volumen es constante. Entonces:
V1P1 = k y V2P2 = k
Y de esto se puede deducir que:
V1P1 = V2P2
Esta última es la expresión o ecuación final para la ley de Boyle.

Se aplica le Ley de Boyle-Mariotte en el funcionamiento de las máquinas a vapor. Es un motor de combustión externa que usa la transformación de la energía térmica de una cantidad de agua en energía mecánica.
Se calienta el agua en una caldera cerrada herméticamente, y el vapor producido ejerce una presión de acuerdo a la ley de Boyle-Mariote que produce una expansión de volumen de un cilindro empujando un pistón.
El movimiento lineal del pistón se transforma en un movimiento rotacional, mediante el uso de un sistema de bielas y manivelas, que puede accionar las ruedas de una locomotora o el rotor de un generador eléctrico.
Actualmente, la máquina de vapor alternativa es un motor poco usado, ya que ha sido desplazado por el motor eléctrico y por el motor de combustión interna en los vehículos de transporte.
La acción de aspirar un refresco o un jugo de una botella mediante un tubo de plástico, está relacionado con la ley de Boyle-Mariotte. Cuando se succiona el aire del tubo utilizando la boca, se produce una disminución de la presión dentro del tubo.
Esta caída de presión facilita el movimiento ascendente del líquido en el tubo, permitiendo su ingestión. Este mismo principio funciona en la extracción de la sangre mediante el uso de una jeringa.
La ley de Boyle-Mariotte está íntimamente relacionada con el funcionamiento del sistema respiratorio. Durante la fase de inspiración, se produce la contracción del diafragma y otros músculos; por ejemplo, los intercostales externos que producen una expansión de la caja torácica.
Esto provoca una disminución en la presión intrapleural, causante de una expansión pulmonar que produce un aumento del volumen pulmonar. Por lo tanto, la presión intrapulmonar disminuye de acuerdo a lo planteado en la ley de Boyle-Mariotte.
Al hacerse subatmosférica la presión intrapulmonar, el aire atmosférico fluye hacia el interior de los pulmones, lo que produce un aumento de la presión en los pulmones; igualando así, su presión a la presión atmosférica, y concluyendo la fase de inspiración.
Posteriormente, se relajan los músculos inspiratorios y se contraen los músculos espiratorios. Además, se produce la retracción elástica pulmonar, fenómeno que produce una disminución en el volumen pulmonar, con un consecuente aumento de la presión intrapulmonar, explicable por la ley de Boyle-Mariotte.
Al aumentar la presión intrapulmonar, y hacerse mayor que la presión atmosférica, el aire fluye del interior de los pulmones hacia la atmósfera. Esto ocurre hasta igualarse las presiones, lo que concluye la fase de espiración.
Se coloca un globo pequeño cerrado herméticamente, haciendo un nudo en su boca, en el interior de una jeringa, a la cual se le ha retirado el émbolo, de aproximadamente de 20 ml. Se coloca el émbolo de la jeringa hacia la parte media de esta, se retira la aguja y se obstruye la entrada de aire.
Observación
Al halar lentamente el émbolo de la inyectadora, se observa que el globo se infla.
Explicación
Sobre la pared del globo se ejercen dos presiones: una presión sobre su cara interior, producto del aire contenido en el interior del globo, y otra presión sobre la cara exterior del globo, ejercida por el aire contenido en la jeringa.
Al halar el émbolo de la inyectadora, se crea en su interior un semivacío. Por lo tanto, disminuye la presión del aire sobre la cara exterior de la pared de la bomba, haciendo que sea relativamente mayor la presión ejercida en el interior de la bomba.
Esta presión neta, de acuerdo a ley de Boyle-Mariote, producirá una distensión de la pared del globo y un aumento del volumen del globo.
Se corta una botella de plástico, aproximadamente por su mitad, procurando que el corte sea lo más horizontal posible. En la boca de la botella se coloca un globo bien ajustado, al mismo tiempo se coloca una cierta cantidad de agua en un plato hondo.
Observación
Al colocar la parte inferior de la botella con el globo sobre el agua del plato, el globo se infla moderadamente.
Explicación
El agua desplaza una cierta cantidad de aire, aumentando la presión del aire sobre la pared de la botella y el interior del globo. Esto provoca, de acuerdo a la ley de Boyle-Mariotte, un aumento de volumen del globo, el cual se visualiza por la inflación del globo.
- Wikipedia. (2019). Boyle’s law. Recuperado de: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (27 de julio de 2018). Boyle’s law. Encyclopædia Britannica. Recuperado de: britannica.com
- Helmenstine, Todd. (05 de diciembre de 2018). The Formula for Boyle’s Law. Recuperado de: thoughtco.com
- Young Indian Films. (15 de mayo de 2018). Boyle’s Law: Science Experiment For Kids. Recuperado de: yifindia.com
- Cecilia Bembibre. (22 de mayo de 2011). Globo aerostático. Definición ABC. Recuperado de: definicionabc.com
- Ganong, W, F. (2003). Fisiología Médica. (19ª Edición). Editorial el Manual Moderno.
