Hidróxido de hierro (II): estructura, propiedades, usos
El hidróxido de hierro (II), también llamado hidróxido ferroso, es un compuesto inorgánico de fórmula química Fe(OH)2. Si su pureza es alta, su sólido se compone únicamente de iones Fe2+ y OH– en una relación 2:1; sin embargo, puede contener moléculas de agua y diferentes especies iónicas, cambiando la posición.
Representa la forma “reducida” de la famosa herrumbre, superficie rojiza compuesta por iones Fe3+; mientras que en la herrumbre verdosa, predomina el Fe2+, junto al OH– y otra cantidad de aniones: CO32-, SO42-, NO3– y haluros (F–, Cl–, …), por ejemplo. El resultado, aunque la base de esta herrumbre verde sea el Fe(OH)2, es que se obtienen diversos sólidos.

En la vida diaria puede contemplarse este hidróxido en lugares comunes. Por ejemplo, el barco de la imagen superior tiene su superficie cubierta de herrumbre verde (no de pátina). Allí está el Fe(OH)2, pero acompañado por numerosos de iones procedentes de las olas del mar.
Químicamente hablando, las propiedades y usos de este material dependen del catión Fe2+ y de su tendencia a oxidarse para transformarse en el Fe3+. Es un agente reductor, el cual reacciona rápidamente con el oxígeno en condiciones básicas. Por lo tanto debe utilizarse en atmósferas inertes y en soluciones ácidas.
Índice del artículo
Considerando únicamente al Fe(OH)2 puro, tiene nada más iones Fe2+ y OH–.
Las interacciones entre ellos deben ser, en teoría, de naturaleza iónica; cada catión Fe2+ atrae dos aniones OH–, cuyas atracciones no direccionales terminan estableciendo un orden estructural y repetitivo que definen un cristal; que a su vez, da lugar al polvo de herrumbre verde.
El problema, es que existe cierto carácter covalente entre ambos iones, y por lo tanto, no puede ignorarse un enlace Fe-OH de carácter iónico. Considerando un enlace parcialmente iónico Fe-OH, puede entenderse que se agrupen en una especie de capa polimérica.
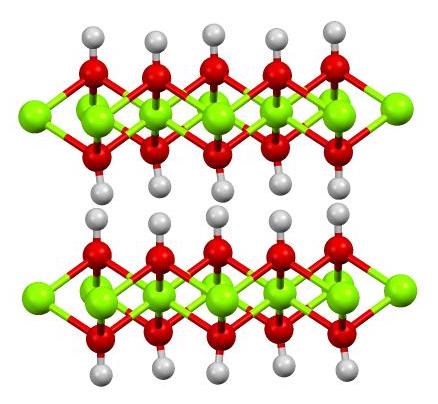
Arriba se muestra la estructura del hidróxido ferroso puro con un modelo de esferas y barras. Los cationes Fe2+ vienen representados por las esferas verde chillón, mientras que los aniones OH– por las esferas rojas y blancas. Nótese cómo se alinean los iones Fe2+ gracias a las interacciones (iónicas-covalentes) con los OH–.
¿Por qué se le llama a esta estructura doble capas de hidróxidos? La imagen por sí misma ofrece la respuesta: hay dos hileras o capas de OH– por cada una de Fe2+; es decir, se mantiene la proporción 2:1 del Fe(OH)2 mencionada al principio.
Las unidades estructurales para el Fe(OH)2 son entonces estos sándwiches, donde las capas de OH– vendrían a representar los panes; panes cargados negativamente y que, por tanto, no logran fijarse adecuadamente para definir un cristal marrón llamativo.
Pero, por otro lado, los átomos de H también se alinean y eclipsan unos con otros. Recordando el concepto de polaridad y electronegatividad, estos hidrógenos presentan una ligera carga parcial positiva, δ+; la cual, aunque débil, puede disponer de una zona positiva donde se alojen otros aniones o moléculas.
Cuando el Fe(OH)2 se disuelve en el agua, sus moléculas se coordinan con el centro metálico de Fe2+ para formar un acuo complejo: [Fe(H2O)4(OH)2]. Este complejo presenta una geometría octaédrica por tener seis ligandos: cuatro moléculas de agua y dos OH–. Sin embargo, en el hidróxido ferroso hidratado el panorama es un poco diferente.
En el hidrato, de fórmula hipotética Fe(OH)2·nH2O, las moléculas de agua se alojan exactamente entre las dos capas de hidróxido; es decir, interaccionan mediante fuerzas dipolo-ion con los hidrógenos o esferas blancas. Es como si se agarraran dos emparedados OHFeOH y se intercalara agua para agruparlos: OHFeOH(H2O)OHFeOH.
Las moléculas de agua son muy dinámicas, impidiendo que las partículas del hidrato adquieran tamaños considerables y, en consecuencia, forman un sólido coloidal o gelatinoso.
En los hidratos las capas de hidróxidos tienen moléculas de agua intercaladas; sin embargo, pueden tener otros aniones (ya mencionados), originando una amplia variedad de herrumbres verdes. Asimismo, pueden incluso “atrapar” moléculas tan grandes como el ADN, o fármacos.
No solamente pueden estar presentes los iones Fe2+, sino también Fe3+, producto de una oxidación interna causada por el oxígeno intercalado. Visiblemente se observaría que la herrumbre (u óxido) verde comienza a tornarse rojiza a medida que aumenta la concentración del Fe3+.

Arriba se muestra Fe(OH)2 precipitado en un tubo de ensayo. Al estar en abundante agua, debe predominar el acuo complejo por encima de la estructura recién mencionada. Observe que la superficie luce un color anaranjado, producto de la oxidación del Fe2+ a Fe3+ por el oxígeno del aire; es decir, este hidróxido es un agente reductor:
Fe2+ => Fe3+ + e–
La apariencia física de este compuesto en estado puro es la de un sólido marrón:

El cual, dependiendo de su nivel de humedad, puede presentarse como un sólido verde gelatinoso. Es bastante insoluble en agua (Ksp= 8·10-16 y solubilidad = 0,72 g/100mL a 25ºC), y tiene una masa molar de 89,86 g/mol y una densidad de 3,4 g/mL.
No están reportados ningún punto de ebullición o fusión para este compuesto; debido probablemente a que, ante una fuente de calor, se deshidrata y convierte en óxido ferroso, FeO:
Fe(OH)2 => FeO + H2O
Su poder reductor se emplea para determinar la presencia de los compuestos nitro, RNO2. La reacción para la cual se obtiene una prueba positiva se representa con la siguiente ecuación química:
RNO2 + 6Fe(OH)2 + 4H2O => RNH2 + 6Fe(OH)3
El Fe(OH)3 precipita como un sólido marrón-rojizo, lo cual certifica la presencia del grupo nitro, -NO2.
El poder reductor del Fe(OH)2 también se ha aprovechado para reducir los aniones SeO32- (selenito) y SeO42- (selenato) a selenio elemental, Se. Prácticamente, permite la remoción de tales aniones, perjudiciales para la salud, en forma de un sólido de selenio insoluble y fácilmente extraíble.
Su estructura pura, y de la herrumbre verde, es fuente de inspiración para el diseño de nuevos materiales de características mineralógicas.
Se estima que la función de estos sea permite el transporte de un especie específica entre sus capas, de tal manera que se pueda controlar o reducir su liberación al sitio activo (suelos, células, superficie metálica, etc.).
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Iron(II) hydroxide. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Ferrous hydroxide. PubChem Database. CID=10129897. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Tests for Phenols and Nitro Groups. Chemistry 211. Recuperado de: academics.wellesley.edu
- Clark Jim. (27 de abril de 2019). Chemistry of iron. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Kingston Technical Software. (2019). Rust Chemistry. Corrosion Doctors. Recuperado de: corrosion-doctors.org
- Zingaro, Ralph A. et al. (1997). Reduction of oxoselenium anions by iron(II) hydroxide. Environment International. 23 (3): 299–304. doi:10.1016/S0160-4120(97)00032-9
