Indio: qué es, estructura, propiedades, usos, riesgos

¿Qué es el indio?
El indio es un metal que pertenece al grupo 13 de la tabla periódica y tiene por símbolo químico In. Su número atómico es 49, 49In, y se presenta en la naturaleza como dos isótopos: 113In y 115In, siendo este último el más abundante. En la Tierra los átomos de indio se encuentran como impurezas en minerales de cinc y plomo.
Es un metal particular, ya que es el más blando que puede tocarse sin muchos riesgos para la salud; a diferencia del litio y rubidio, que quemarían terriblemente la piel al reaccionar con su humedad. Un trozo de indio puede cortarse con un cuchillo y fracturarse con la fuerza de los dedos, emitiendo un crujido distintivo.
Quien escuche nombrar a este metal seguro le vendrá a la mente la India, pero su nombre deriva del color índigo, el cual se observa cuando se realiza el ensayo de la llama. En este sentido se parece bastante al potasio, ardiendo su metal o sus compuestos con una llama muy característica, mediante la cual se detectó el indio por vez primera en minerales de esfalerita.
El indio comparte muchas cualidades químicas con el aluminio y galio, presentándose en la mayoría de sus compuestos con un número de oxidación de +3 (In3+). Se combina excelentemente con el galio formando aleaciones con bajos puntos de fusión, siendo una de ellas la galinstan.
Las aplicaciones del indio se basan en el revestimiento de materiales con sus aleaciones, volviéndolas conductoras eléctricas y flexibles. El indio reviste algunos vidrios para concederles mayores brillos, sustituyendo a la plata. En el mundo de la tecnología, el indio se encuentra en las pantallas táctiles y LCD.
Descubrimiento
En 1863, el químico alemán Ferdinand Reich buscaba rastros del elemento talio, mediante la línea verde de su espectro de emisión, en minerales de cinc; específicamente muestras de esfalerita (ZnS) por los alrededores de Sajonia. Después de tostar los minerales, removerles su contenido de azufre, digerirlos en ácido clorhídrico, y destilarles el cloruro de cinc, obtuvo un precipitado de color pajizo.
Ante el hallazgo, Reich decidió realizar un análisis espectroscópico; pero debido a que no tenía buenos ojos para observar los colores, acudió a su colega Hieronymus Theodor Richter para que lo ayudara en esta tarea. Richter fue quien observó una línea espectral azulada, la cual no coincidía con el espectro de ningún otro elemento.
Los dos químicos alemanes estaban frente a un nuevo elemento, que recibió el nombre de indio por el color índigo de la llama cuando se quemaban sus compuestos; y a su vez, el nombre de este color deriva de la palabra latina indicum, que significa India.
Un año más tarde, en 1864, entusiasmados y tras una serie prolongada de precipitaciones y purificaciones, aislaron una muestra de indio metálico mediante la electrólisis de sus sales disueltas en agua.
Estructura del indio
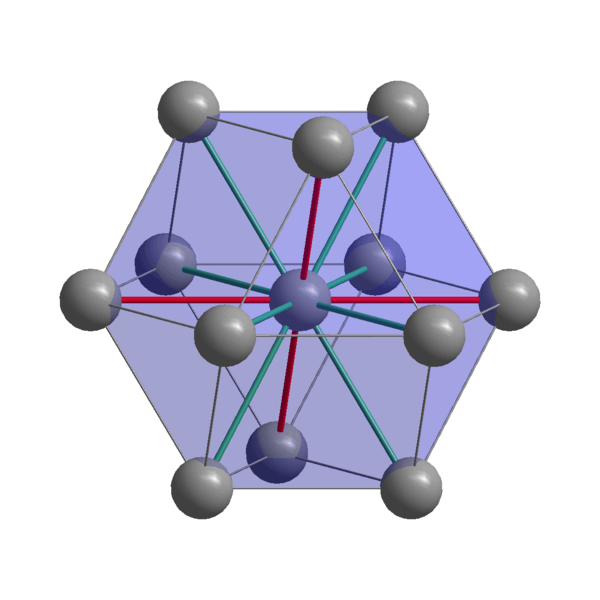
Los átomos de indio, In, cohesionan utilizando sus electrones de valencia para establecer un enlace metálico. Así, terminan ordenándose en un cristal de estructura distorsionada tetragonal centrado en el cuerpo. Las interacciones entre los átomos vecinos In-In en el cristal, son relativamente débiles, lo cual explica por qué el indio tiene un punto de fusión bajo (156 ºC).
Por otro lado, las fuerzas que unen dos o más cristales de indio tampoco son fuertes, pues de lo contrario no se desplazarían unos encima de otros, confiriéndole al metal su blandura característica.
Propiedades del indio
Apariencia física
Es un metal plateado notablemente blando. Puede rasgarse con la presión de la uña, cortarse con un cuchillo, o rayarse en trazos brillantes sobre una hoja de papel. Incluso es posible masticarlo y deformarlo con los dientes, siempre que esté aplanado. Asimismo, es muy dúctil y maleable, teniendo propiedades plásticas.
Cuando el indio se le calienta con un soplete despide una llama de color índigo, aún más brillante y colorida que la del potasio.
Masa molar
114,81 g/mol
Punto de fusión
156,60 ºC
Punto de ebullición
2072 ºC.
Al igual que el galio, el indio tiene un gran intervalo de temperatura comprendido entre su punto de fusión y el de ebullición. Esto refleja el hecho de que las interacciones In-In en el líquido son más fuertes que las que predominan en el cristal; y que por lo tanto, es más fácil obtener una gota de indio que sus vapores.
Densidad
A temperatura ambiente: 7,31 g/cm3
Justo en el punto de fusión: 7,02 g/cm3
Electronegatividad
1,78 en la escala de Pauling
Energías de ionización
Primera: 558,3 kJ/mol
Segunda: 1820,7 kJ/mol
Tercera: 2704 kJ/mol
Conductividad térmica
81,8 W/(m·K)
Resistividad eléctrica
83,7 nΩ·m
Dureza de Mohs
1,2. Apenas es un poco más duro que el talco (no confundir tenacidad con dureza).
Reactividad
El indio se disuelve en ácidos para originar sales, pero no se disuelve en soluciones alcalinas, ni siquiera con hidróxido de potasio en caliente. Reacciona en contacto directo con el azufre, el oxígeno y los halógenos.
El indio es relativamente anfotérico, pero se comporta más como base que como ácido, siendo sus disoluciones acuosas ligeramente básicas. El In(OH)3 se redisuelve con la adición de más álcalis originando los complejos indiatos, In(OH)4–, tal como sucede con los aluminatos.
Configuración electrónica
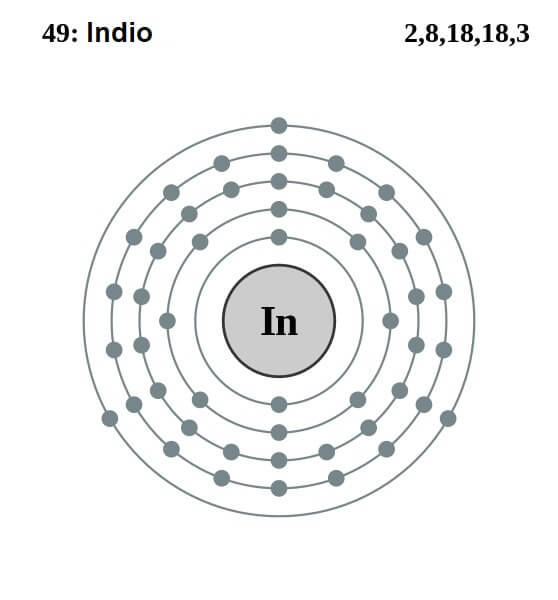
La configuración electrónica del indio es la siguiente:
[Kr] 4d10 5s2 5p1
De esos trece electrones, los tres últimos de los orbitales 5s y 5p son los de valencia. Con estos tres electrones los átomos de indio establecen su enlace metálico, como lo hace el aluminio y el galio, y forma enlaces covalentes con otros átomos.
Números de oxidación
Lo anterior dicho sirve para sobreentender de una vez que el indio es capaz de perder sus tres electrones de valencia, o ganar cinco para volverse isoelectrónico al gas noble xenón.
Si en un compuesto asumimos que ha perdido sus tres electrones, quedará como el catión trivalente In3+ (en analogía al Al3+ y Ga3+) y, por lo tanto, su número de oxidación será +3. La mayoría de los compuestos del indio son In(III).
Entre otros números de oxidación encontrados para el indio tenemos: -5 (In5-), -2 (In2-), -1 (In–), +1 (In+) y +2 (In2+).
Algunos ejemplos de compuestos In(I) son: InF, InCl, InBr, InI y In2O. Todos ellos son compuestos relativamente raros, mientras que los de In(III) son los predominantes: In(OH)3, In2O3, InCl3, InF3, etc.
Los compuestos In(I) son poderosos agentes reductores, en los cuales el In+ dona dos electrones a otras especies para convertirse en In3+.
Isótopos
El indio se presenta en la naturaleza como dos isótopos: 113In y 115In, cuyas abundancias terrestres son 4,28% y 95,72%, respectivamente. Por lo tanto, en la Tierra tenemos muchos más átomos de 115In que de 113In. El 115In tiene un tiempo de vida media de 4,41·1014 años, tan grande que prácticamente se le considera estable, a pesar de ser un radioisótopo.
En la actualidad se han creado un total de 37 isótopos artificiales de indio, todos radiactivos y muy inestables. De todos ellos, el más estable es el 111In, el cual tiene un tiempo de vida media de 2,8 días.
Usos/aplicaciones
Aleaciones
El indio se lleva muy bien con el galio. Ambos metales forman aleaciones que funden a bajas temperaturas, luciendo como líquidos plateados, con los cuales se suplanta al mercurio en varias de sus aplicaciones. Asimismo, el indio también se amalgama con facilidad, teniendo en el mercurio una solubilidad de un 57%.
Las aleaciones de indio se utilizan para diseñar espejos plateados sin necesidad de recurrir de la plata. Cuando se vierten sobre una superficie de cualquier material, actúa como un adherente, de tal modo que puede juntarse placas de vidrio, metal, cuarzo y cerámicas.
Electrónica

El indio también se lleva bien con el germanio, por lo que sus compuestos se adicionan como dopantes al nitruro de germanio de los LEDs, reproduciéndose de estas mezclas luces azules, moradas y verdes. Asimismo, forma parte de los transistores, termistores y de las celdas fotovoltaicas.
El más importante de sus compuestos es el óxido de estaño e indio, el cual se utiliza como revestimiento de vidrios para reflejar algunas longitudes de onda. Esto le permite ser utilizado en las gafas para soldar, y en los vidrios de los rascacielos para que no se calienten por dentro.
Los vidrios recubiertos con este óxido son buenos conductores de la electricidad; como la proveniente de nuestros dedos. Y es por eso que se destina para la fabricación de pantallas táctiles, actividad aún más vigente hoy en día debido al surgimiento de cada vez más teléfonos inteligentes.
Riesgos

El indio no representa ningún riesgo para el medio ambiente en primera instancia, pues sus iones In3+ no se encuentran diseminados en cantidades apreciables. No hay información respecto a cuál sería su impacto en los suelos, afectando a las plantas, y tampoco en la fauna o en los mares.
En el organismo se desconoce si los iones In3+ tienen alguna participación esencial en el metabolismo en cantidades trazas. No obstante, cuando sus compuestos se ingieren, resultan perjudiciales para varios órganos, razón por la que se consideran como sustancias altamente tóxicas.
De hecho las partículas de ITO (óxido de estaño e indio, por sus siglas en inglés: Indium Tin Oxide), indispensables para la fabricación de pantallas para computadoras y teléfonos inteligentes, pueden llegar a impactar negativamente en la salud de los trabajadores, causándoles una enfermedad llamada pulmón de indio.
La ingesta de estas partículas se da sobre todo por inhalación y por contacto a través de la piel y los ojos.
Por otro lado, las partículas finas de indio metálico son propensas a arder y ocasionar incendios si están cercas de una fuente de calor.
