Tetrosas: características, eritrosa, sintesis, derivados
Las tetrosas son monosacáridos de cuatro carbonos, cuya fórmula empírica es C4H8O4. Hay dos tipos de tetrosas: aldosas (tienen un grupo aldehído terminal, carbono 1 o C-1) y cetosas (tienen un grupo cetona en el átomo de carbono 2, C-2).
No se han encontrado tetrosas como productos naturales, pero es posible hallarlas en su forma reducida, tales como el eritritol, que es un tetrahidroxialcohol. En los líquenes, el eritritol es sintetizado mediante la descarboxilación del ácido D-arabónico.
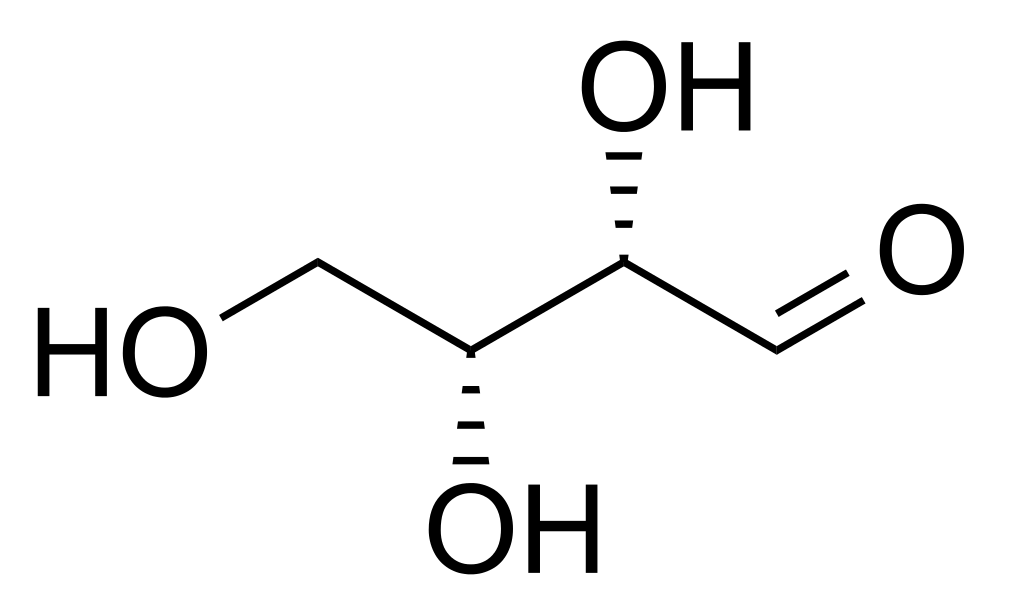
Las treosas no forman parte estructural de los seres vivos. Sin embargo las treosas, tales como la eritrosa, se encuentran en vías metabólicas.
Índice del artículo
- 1 Características
- 2 La eritrosa en el metabolismo
- 3 La eritrosa en la vía de la pentosa fosfato y en el ciclo de Calvin
- 4 Eritrosa: biosíntesis de aminoácidos esenciales y aromáticos
- 5 El eritritol es un derivado de la eritrosa
- 6 Síntesis prebiótica de tetrosas
- 7 Referencias
En las aldotetrosas hay dos átomos de carbono quirales, C-2 y C-3, y el carbono 6 (C-6). Mientras que en las cetotetrosas hay solo un átomo de carbono quiral, el carbono 3 (C-3).
Los azúcares, como la tetrosa, con la configuración D son más abundantes que los azúcares con la configuración L.
Hay dos aldotetrosas con configuración D (D-eritrosa y D-treosa), y una cetotetrosa con configuración D (D-eritrulosa).
Las proyecciones de Fischer se hacen mediante la orientación de la molécula en una conformación eclipsada con un el grupo aldehído por arriba. Los cuatro átomo de carbono definen la cadena principal de la proyección, siendo organizados verticalmente. Los enlaces horizontales apuntan hacia afuera y los verticales hacia atrás.
A diferencia de los monosacáridos que poseen cinco o más carbonos, los cuales experimentan reacciones intramoleculares para formar hemiacetales y hemicetales, las tetrosas no pueden formar estructuras cíclicas.
La eritrosa es la única tetrosa que se encuentra en el metabolismo de numerosos organismos. Las vías metabólicas en las que se encuentra son:
– Vía de la pentosa fosfato
– Ciclo de Calvin
– Vías de biosíntesis de aminoácidos esenciales y aromáticos.
En todas estas vías metabólicas, la eritrosa participa como un éster fosfato, la eritrosa 4-fosfato. A continuación se describe el papel de la eritrosa 4-fosfato en estas vías.
Ambas vías metabólicas tienen en común la biosíntesis de eritrosa 4-fosfato con la participación de enzimas transcetolasas y transaldolasas.
Ambas enzimas catalizan la transferencia de un pequeño fragmento de carbono de una cetosa donadora a una aldosa aceptora para producir una aldosa nueva de cadena más corta y una cetosa de cadena más larga.
En la vía de la pentosa fosfato, la biosíntesis de eritrosa-4-fosfato sucede a partir de dos substratos, la sedoheptulosa 7-fosfato, una cetoheptosa, y el gliceraldehído 3-fosfato, una aldotriosa, los cuales son convertidos en eritrosa 4-fosfato, una aldotetrosa, y fructosa 6-fosfato, una cetohexosa, mediante la catálisis de una transaldolasa.
En el ciclo de Calvin, la biosíntesis de eritrosa-4-fosfato sucede a partir de dos substratos, la fructosa 6-fosfato, una cetohexosa, y el gliceraldehído 3-fosfato, así como un aldotriosa. Estos son convertidos en eritrosa 4-fosfato, una aldotetrosa, y xilulosa 5-fosfato, una cetopentosa, mediante la catálisis de una transcetolasa.
La biosíntesis de eritrosa 4-fosfato en la vía pentosa fosfato tiene como finalidad la biosíntesis de gliceraldehído 3-fosfato y la fructosa 6-fosfato, que pueden continuar por la vía gluconeogénica y la vía pentosa fosfato. La biosíntesis de eritrosa 4-fosfato en el ciclo de Calvin permite reponer la ribulosa 1,5 bifosfato para reiniciar el ciclo con la fijación de CO2.
En bacterias, hongos y plantas, la biosíntesis de los aminoácidos aromáticos fenilalanina, tirosina y triptófano comienza con los precursores fosfoenolpiruvato y eritrosa 4-fosfato. Estos precursores son convertidos primero en shikimato y después en corismato, una secuencia de siete pasos catalizados por enzimas.
A partir del corismato hay una bifurcación. Por un lado una vía culmina con la biosíntesis de triptófano, por el otro el corismato produce tirosina y fenilalanina.
Debido a que la biosíntesis de aminoácidos aromáticos solo sucede en plantas y microorganismos, esta vía es un blanco de herbicidas, tales como el glifosato, que es el ingrediente activo del RoundUp. Este último es un producto comercial de Monsanto, que actualmente pertenece a la compañía Bayer.
El glifosato es un inhibidor competitivo con respecto al fosfoenolpiruvato en la reacción de la 5-enolpiruvilshikimato 3-fosfato sintasa (EPSP).
El eritritol es la forma reducida de la eritrosa y comparte características funcionales con otros polioles, tales como relativa estabilidad en ambientes ácidos y alcalinos, alta estabilidad ante el calor, sabor similar al de la sacarosa (bajo en calorías), no tener potencial carcinogénico, entre otras características.
El eritritol es capaz de suprimir las bacterias dañinas y reducir la placa dental. A diferencia de otros polioles, entre los que se incluyen el sorbitol y el xilitol, el eritritol es rápidamente absorbido por el intestino delgado, no es metabolizado y es excretado por la orina. El consumo frecuente de eritritol reduce la incidencia de caries dental y restaura la superficie dental.
Los estudios sobre el eritritol, el xilitol y el sorbitol demostraron que estos azúcares se diferencian en su eficacia contra las caries. El xilitol y el sorbitol son menos eficaces para prevenir las caries y las enfermedades periodentales.
La síntesis de monosacáridos en el mundo prebiótico debe haber jugado un papel esencial en el origen de la vida ya que estos compuestos son fuentes de energía y componentes de otras biomoléculas.
El formaldehido (CH2=O), el carbohidrato más simple, se cuenta entre las más abundantes de las ~140 moléculas interestelares conocidas. En la atmósfera de la Tierra Primitiva, se generaba por acción de radiaciones ionizantes, luz UV, y descargas eléctricas sobre moléculas de metano, amoniaco y agua.
El formaldehido se habría precipitado de la atmósfera, incorporándose a corrientes de agua caliente (60–80 °C) que habrían erosionado las rocas terrestres, arrastrando iones de calcio.
Estos iones habrían catalizado una reacción que convierte una molécula de formaldehido y una molécula de formaldehido protonado (CH2=OH+) en una de glicolaldehido protonado (HOCH2CH=OH+).
El glicolaldehido protonado habría interactuado con el formaldehido para producir triosas+, las cuales habrían interactuado otra vez con el formaldehido para producir tetrosas+. La repetición de esta autocatálisis habría producido monosacáridos con mayor número de carbonos.
Las quiralidades de las tetrosas y otros monosacáridos podrían reflejar las quiralidades de aminoácidos presentes en el medio acuoso, los cuales también habrían actuado como catalizadores para la formación de monosacáridos.
- Carey, F. A., Giuliano, R. M. 2016. Organic chemistry. McGraw-Hill, Nueva York.
- Cui, S. W. 2005. Food carbohydrates: chemistry, physical properties, and applications. CRC Press, Boca Raton.
- Cui, S. W. 2005. Food carbohydrates: chemistry, physical properties, and applications. CRC Press, Boca Raton.
- Gardner, T. S. 1943. The problem of carbohydrate formation in nature. Journal of Organic Chemistry, 8, 111–120.
- Jalbout, A. F. 2008. Prebiotic synthesis of simple sugars by an interstellar formose reaction. Origins of Life and Evolution of the Biosphere, 38, 489–497.
- Kim, H.-J., et al. 2011. Synthesis of carbohydrates in mineral-guided prebiotic cycles. Journal of the American Chemical Society, 133, 9457–9468.
- Lambert, J. B., Gurusamy-Thangavelu, S. A., Ma, K. 2010. The silicate-mediated formose reaction: bottom-up synthesis of sugar silicates. Science, 327, 984–986.
- Lamour, S., Pallmann, S., Haas, M., Trapp, O. 2019. Prebiotic sugar formation under nonaqueous conditions and mechanochemical acceleration. Life 2019, 9, 52; doi:10.3390/life9020052.
- Linek, K., Fedoroňko, M. 1972. The interconversion of the D-tetroses in pyridine. Carbohydrate Research, 21, 326–330.
- Nelson, D. L., Cox, M. M. 2017. Lehninger Principles of Biochemistry. W. H. Freeman, Nueva York.
- Pizzarello, S., Shock, E. 2010. The organic composition of carbonaceous meteorites: the evolutionary story ahead of biochemistry. Cold Spring Harbor Perspectives in Biology, 2010;2:a002105.
- Pizzarello, S., Weber, A. L. 2010. Stereoselective syntheses of pentose sugars under realistic prebiotic conditions. Origins of Life and Evolution of the Biosphere, 40, 3–10.
- Sinnott, M. L. 2007. Carbohydrate chemistry and biochemistry structure and mechanism. Royal Society of Chemistry, Cambridge.
- Stick, R. V., Williams, S. J. 2009. Carbohydrates: the essential molecules of life. Elsevier, Amsterdam.
- Tomasik, P. 2004. Chemical and functional properties of food saccharides. CRC Press, Boca Raton.
- Voet, D., Voet, J. G., Pratt, C. W. 2008. Fundamentals of biochemistry – life at the molecular level. Wiley, Hoboken.
- Nelson, D. L., Cox, M. M. 2017. Lehninger Principles of Biochemistry. W. H. Freeman, Nueva York.
- Pizzarello, S., Weber, A. L. 2004. Prebiotic amino acids as asymmetric catalysts. Science, 3003, 1151.
- Sinnott, M. L. 2007. Carbohydrate chemistry and biochemistry structure and mechanism. Royal Society of Chemistry, Cambridge.
- Stick, R. V., Williams, S. J. 2009. Carbohydrates: the essential molecules of life. Elsevier, Amsterdam.
