Fórmula estructural (con ejemplos)
La fórmula estructural es una representación gráfica de los enlaces de una molécula, arrojando luz sobre su estructura una vez determinada por métodos espectroscópicos. Es la manera más concreta al momento de referirse a un compuesto en específico, y no a varios isómeros correspondientes a una misma fórmula molecular.
Por ejemplo, el butano, C4H10, tiene dos isómeros: n-butano (lineal) y 2-metil-propano (ramificado). La fórmula molecular no discrimina entre ninguno de los dos; mientras que si recurrimos a las fórmulas estructurales, se verá precisamente que uno es lineal y el otro ramificado.
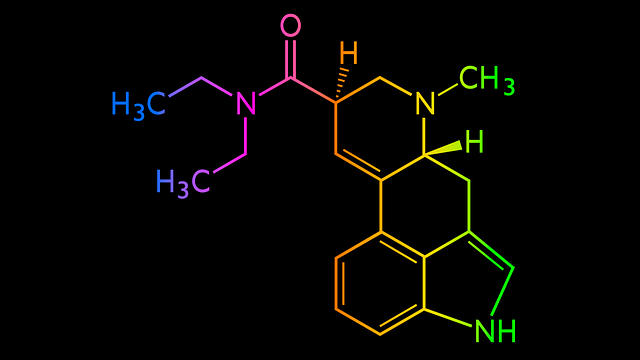
Utilizar fórmulas estructurales facilita la comprensión de los cambios que sufre una molécula durante una reacción química; cuáles de sus enlaces se rompen, cómo se ve modificada su estructura en el proceso y al final del mismo. Aprender a leer dichas fórmulas es igual a predecir superficialmente las propiedades de las moléculas.
Las fórmulas estructurales son representaciones 2D, aunque en ellas pueden señalarse algunos aspectos tridimensionales y geométricos. Mientras más se investiga la estructura de un compuesto, más refinada y fiel termina volviéndose su fórmula estructural. De lo contrario, deja de lado aspectos esenciales para entender la naturaleza de la molécula.
Índice del artículo
Cada compuesto posee su respectiva fórmula estructural, la cual puede variar dependiendo del tipo de proyección o perspectiva usadas. Por ejemplo, las fórmulas condensadas y esqueletal, las estructuras de Lewis, y las proyecciones estereoquímicas, todas son fórmulas estructurales, dedicadas a graficar la máxima información posible concerniente a la estructura molecular.
Son tantas que apenas se abordarán algunos ejemplos simples.
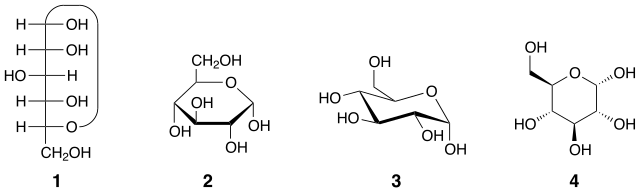
En la imagen superior se muestran cuatro representaciones de la molécula de glucosa. Cada una es una fórmula estructural válida; pero la 2 (proyección Haworth) y la 3 (proyección silla) suelen ser las más empleadas en los textos académicos y en las publicaciones.
La 4 tiene la ventaja de que indica directamente qué grupos OH se encuentran por encima (cuñas gruesas) o por debajo (cuñas punteadas) del anillo hexagonal; es decir, facilita la comprensión de su estereoquímica. En cambio, la 1 (proyección Tollens-Fisher) muestra el carácter lineal de la glucosa antes de convertirse en su forma cíclica.
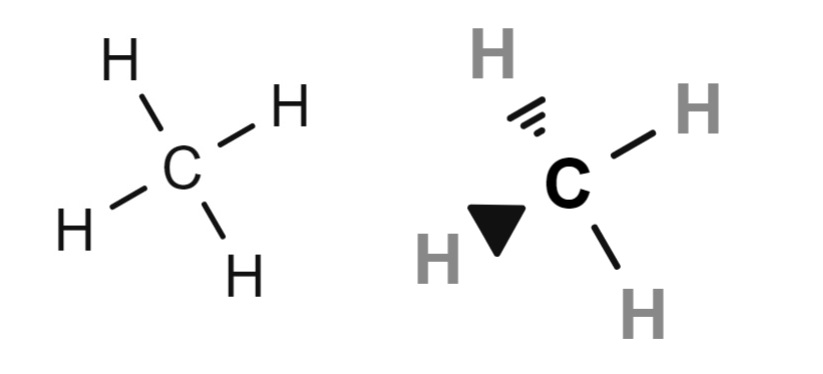
Arriba se tiene dos fórmulas estructurales del metano, cuya fórmula molecular y condensada es CH4. Para quienes carecen de conocimientos de química, pudieran interpretar la fórmula CH4 como si se tratara de una molécula con un átomo de hidrógeno en el centro.
Pero en realidad (y necesariamente), las fórmulas estructurales aclaran que es el carbono el átomo central. Por lo tanto, tenemos cuatro enlaces C-H. Nótese además que la fórmula de la izquierda genera la falsa impresión de que la molécula es plana, cuando en realidad es tetraédrica (fórmula de la derecha).
Es por eso que en la fórmula estructural de la derecha los enlaces vienen representados por cuñas, indicando las posiciones espaciales relativas de cada átomo de hidrógeno (vértices del tetraedro).
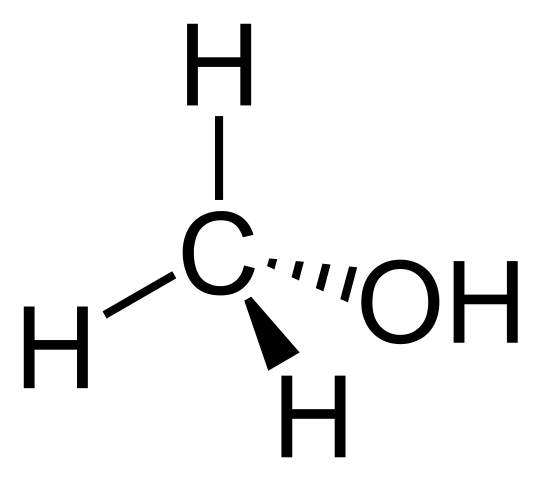
La fórmula estructural del metanol es prácticamente la misma que la del metano, con la diferencia de que presenta un H sustituido por un OH. Su fórmula condensada o química es CH3OH, y la molecular CH4O. Se observa que también consiste de un tetraedro.
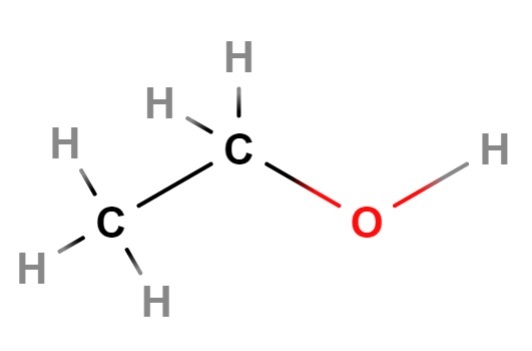
Ahora seguimos con el etanol, el siguiente alcohol de la lista. Su fórmula química o condensada es CH3CH2OH, la cual por sí sola ya evidencia su estructura lineal. Para salir de dudas, la fórmula estructural de la imagen superior demuestra efectivamente que el etanol es de cadena o esqueleto lineal.
Si se observa detenidamente, los entornos de cada átomo de carbono son tetraédricos.
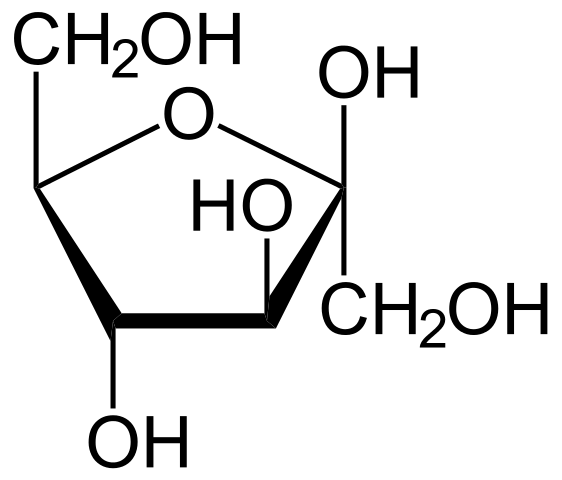
Arriba tenemos la formula estructural de la fructosa, más precisamente la proyección Haworth de su anillo furanoso (de cinco miembros). Nótese lo mucho que revela la fórmula estructural a diferencia de la molecular, C6H12O6, la cual coincide con la de la glucosa, siendo ambas sin embargo azúcares distintos.
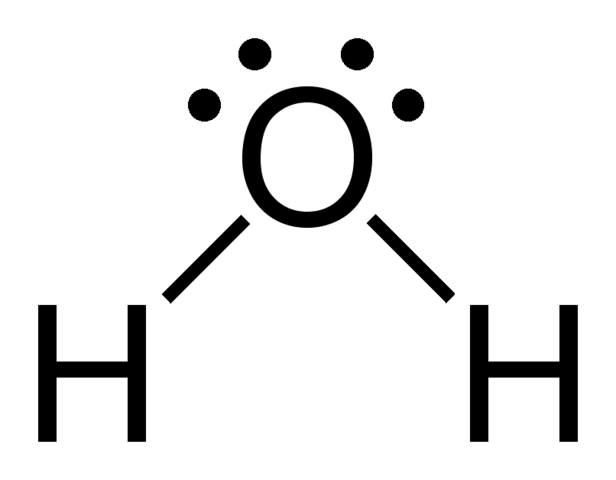
La fórmula química del agua es H2O, correspondiendo además con las fórmulas condensada y molecular. Tal como sucede con el metano, quienes desconocen la molécula del agua (y no tienen ninguna noción de los enlaces químicos) pudieran creer que su estructura es O-H-H; pero la fórmula estructural de la imagen superior aclara la verdadera estructura.
Aunque no se aprecie, los pares de electrones libres del oxígeno y los átomos de hidrógeno dibujan un tetraedro entorno al oxígeno; esta es, la geometría electrónica del agua: tetraédrica. Mientras, los dos átomos de hidrógeno establecen un plano parecido a un boomerang; esta es, la geometría molecular del agua: angular.
Si bien la fórmula estructural del agua es por lejos la más simple de los ejemplos abordados, esconde más secretos y anomalías de las que por sí sola logra representar.
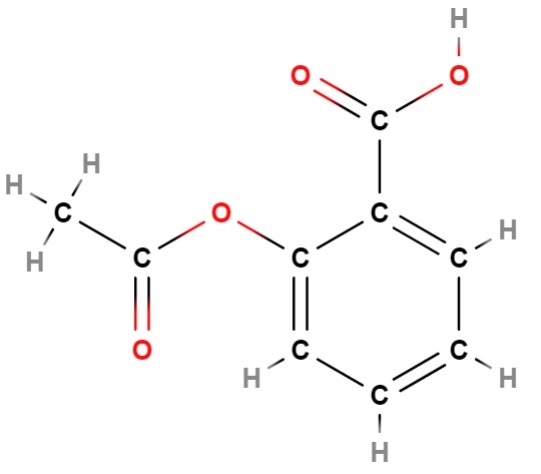
Tenemos una de las primeras “fallas” de las fórmulas estructurales: su incapacidad de representar el carácter aromático de una estructura; que en este caso, corresponde a la aromaticidad del anillo bencénico (hexagonal) de la aspirina (arriba).
Si se observa esta fórmula detenidamente, se llegará a la conclusión de que se trata de una molécula en esencia plana; es decir, casi todos sus átomos “descansan” en un mismo plano, a excepción del grupo metilo, CH3, a su izquierda, donde vuelve a visualizarse el entorno tetraédrico del carbono.
Nuevamente, la fórmula estructural aporta mucha más información que su llana fórmula molecular, C9H8O4; la cual, corresponde a numerosos isómeros estructurales, totalmente diferentes a la aspirina.
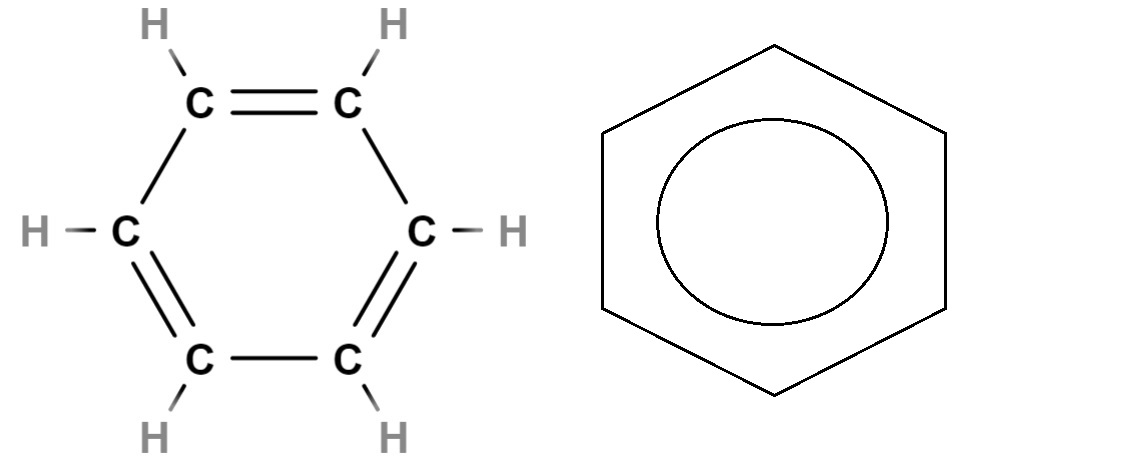
Para finalizar, tenemos arriba la fórmula estructural del benceno. Su fórmula molecular es C6H6, indicando que efectivamente contiene seis átomos de carbono y seis átomos de hidrógeno. Pero no dice nada acerca de la verdadera estructura del benceno.
Los dobles enlaces C=C no se encuentran estáticos, pues un par de electrones, específicamente el ubicado en los orbitales p del carbono, se deslocaliza dentro del anillo. En consecuencia, el benceno posee varias estructuras de resonancia, cada una con su propia fórmula estructural.
Esta deslocalización es parte del carácter aromático del benceno, no representado fielmente en la fórmula estructural de la izquierda. Lo más aproximado es sustituir los dobles enlaces por un círculo (llamado dona por algunos) para indicar la aromaticidad del anillo (derecha de la imagen).
¿Y qué hay de la fórmula esqueletal? Esta es muy similar a la estructural, diferenciándose únicamente en que no representa los átomos de hidrógeno; y por lo tanto, es más simplificada y resulta más cómoda de graficar. El anillo de benceno de la derecha vendría a ser su fórmula esqueletal.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Structural formula. Recuperado de: en.wikipedia.org
- Nissa Garcia. (2020). Structural Formula: Definition & Examples. Study. Recuperado de: study.com
- Clark Jim. (2012). Drawing Organic Molecules. Recuperado de: chemguide.co.uk
- William Reusch. (05 de mayo de 2013). The Shape of Molecules. Recuperado de: 2.chemistry.msu.edu
