Nucleófilo: ataque nucleofílico, tipos, ejemplos, nucleofilicidad
Un nucleófilo es todo átomo, ion o molécula que busca donar pares de electrones a sustancias con cargas o regiones positivas. La palabra quiere decir ‘amor por los núcleos’. Cuando un átomo o una región molecular es pobre en electrones, experimenta una fuerza de atracción mayor por parte de los núcleos atómicos; y precisamente, esta atracción atrae a los nucleófilos.
Por lo tanto, como las cargas de signos contrarios se atraen, los nucleófilos deben ser especies negativas; o por lo menos, poseedoras de regiones altamente negativas a causa de una concentración local o dispersa de electrones.
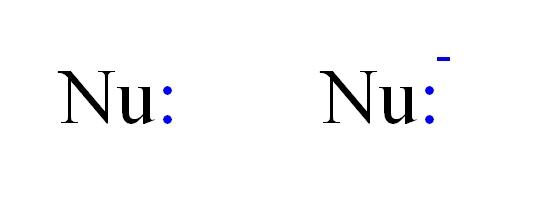
Así, un nucleófilo puede representarse por las letras Nu, tal como en la imagen de arriba. Los dobles puntos en azul corresponden a un par de electrones, el cual donan al electrófilo; este es, el átomo o molécula deficiente de electrones. Nótese que el nucleófilo puede ser neutro o aniónico, sin embargo ambos donan pares de electrones.
El ataque de los nucleófilos a los electrófilos es la piedra angular de infinidad de reacciones y mecanismos orgánicos. Un ejemplo de nucleófilo es el anión hidroxilo, OH–, que se comporta además como una base. No obstante, no debe confundirse nunca la nucleofilicidad con la basicidad de una sustancia.
Índice del artículo
Los nucleófilos buscan núcleos o electrófilos, lo que significa que van detrás de cargas o regiones positivas de una molécula. La ecuación química siguiente representa el ataque nucleófilo:
Nu: + R-LG → R-Nu + LG:
El nucleófilo Nu: dona su par de electrones a R, el cual está enlazado a un grupo saliente electronegativo LG. Al hacerlo, se rompe el enlace R-LG, sale o emigra LG:, y se forma el nuevo enlace R-Nu. Esta es la base para muchas reacciones orgánicas.
Se verá en el siguiente apartado que un nucleófilo puede ser incluso un anillo aromático, cuya densidad electrónica se halla dispersa en su centro. Asimismo, un nucleófilo puede llegar a ser un enlace sigma, lo que significa que los electrones del mismo emigran o saltan a núcleos cercanos.
Existen varios tipos de nucleófilos, pero la gran mayoría consiste de especies con pares de electrones libres, dobles enlaces, o enlaces sigmas que participan en mecanismos moleculares.
Cuando se habla de especies con pares de electrones libres, nos referimos a aniones, o a moléculas con átomos electronegativos, tales como el oxígeno, nitrógeno y azufre. En el apartado de ejemplos se verán muchos nucleófilos de este tipo, aparte del anión OH– ya mencionado.
Un nucleófilo puede tener dobles enlaces, los cuales son los responsables del ataque nucleofílico. Sin embargo, deben tratarse de dobles enlaces con una densidad electrónica apreciable, por lo que no cualquier molécula que los posea se considerará un nucleófilo fuerte; es decir, no tendrá una alta nucleofilicidad.
Por ejemplo, considérese el anillo de benceno en la siguiente reacción de alquilación (reacción de Friedel-Crafts):
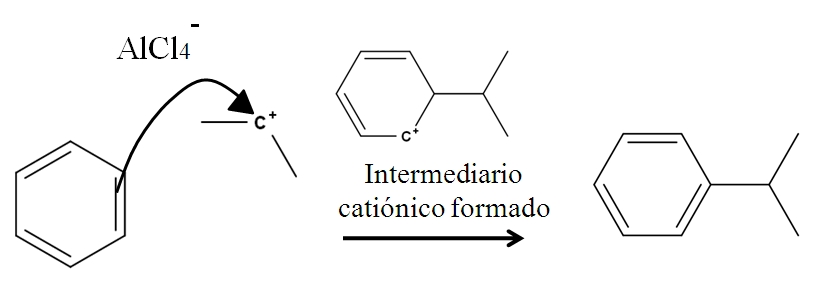
La presencia de una mezcla AlCl3-(CH3)2CHCl origina el carbocatión isopropilo. Su carga positiva e inestabilidad atrae fuertemente los electrones de uno de los dobles enlaces del benceno, los cuales atacan al carbocatión, tal como se representa con la flecha.
En el proceso, se forma un breve intermadiario catiónico y aromático, el cual se transforma finalmente en el producto que está a la derecha.
Así como sucede con el benceno, otras sustancias con dobles enlaces pueden actuar como nucleófilos, siempre que las condiciones de reacción sean las más apropiadas. Igualmente, debe haber átomos situados cerca del doble enlace que donen densidad electrónica, de manera que se “recarguen” de electrones.
Los enlaces sigmas como tal no son nucleófilos; pero puede comportarse como tales una vez se inicia una reacción y comienza el mecanismo. Considérese el siguiente ejemplo:
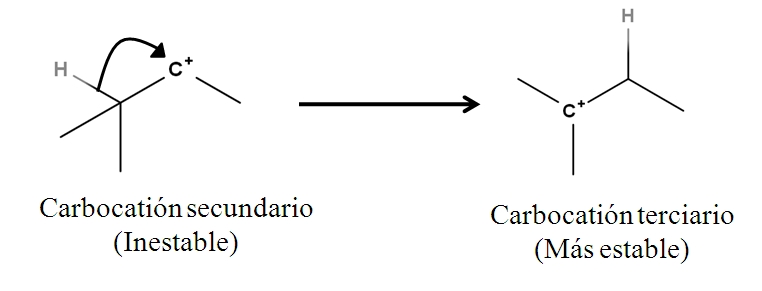
El enlace sigma C-H adyacente al carbocatión se desplaza hacia él comportándose como un nucleófilo (ver movimiento de la flecha curvada). En este sentido, el resultado es que se mueve el anión H– al carbono vecino, pero tan rápidamente que se considera el enlace sigma y su par de electrones como el agente nucleofílico de este mecanismo.
En este apartado se mencionarán varios ejemplos del primer tipo de nucleófilos, los cuales son muy abundantes e importantes en química orgánica e inorgánica.
Los halogenuros (F–, Cl–, Br– y I–) son nucleófilos. Tienen para donar uno de cualquiera de sus cuatro pares de electrones de valencia. Dependiendo de la rapidez con que uno de estos halogenuros ataque al electrófilo, tendrá mayor o menor nucleofilicidad.
En general, el I– es mejor nucleófilo que F– y los demás halogenuros, ya que se le hace más fácil formar un enlace covalente por ser más polarizable; esto es, más voluminoso y con menor tenacidad a ceder su par de electrones.
El agua, HOH, es un nucleófilo, porque el átomo de oxígeno tiene alta densidad negativa y pares de electrones libres para donar y formar un enlace covalente. Asimismo, los alcoholes, ROH, son nucleófilos, por las mismas razones que las del agua.
Las moléculas nitrogenadas pequeñas, como el amoníaco, :NH3, también tienden a ser nucleófilos. Esto se debe a que el nitrógeno puede donar su par solitario de electrones. De igual modo, las aminas, RNH2, también son nucleófilos.
Y además de las moléculas pequeñas con oxígeno o nitrógeno, las sulfuradas también cuentan como nucleófilos. Este es el caso del sulfuro de hidrógeno, H2S, y los tioles, RSH.
El azufre es mejor nucleófilo que el oxígeno y el nitrógeno debido a que es menos “aferrado” a su par de electrones, por lo que se le es más fácil donarlo. A este hecho también debe agregarse que su átomo es más voluminoso, es decir, más polarizable, y por lo tanto capaz de formar enlaces covalentes con menor dificultad.
Los aniones oxigenados, nitrogenados, sulfurados, y en general varios de ellos, son nucleófilos fuertes. Esto se debe a que ahora disponen de una carga negativa que intensifica todavía más la presencia del par de electrones que donarán.
Considérese por ejemplo los siguientes aniones colocados en orden decreciente de nucleofilicidad:
:CH3– > :NH2– > :OH– > :F–
El carboanión CH3– es el nucleófilo más fuerte debido a que el átomo de carbono no estabiliza la carga negativa, cuyos electrones están “desesperados” por núcleos cercanos. No sucede así con el amiduro, NH2–, cuyo átomo de nitrógeno estabiliza mejor la carga negativa y cede el par de electrones con mayor facilidad que el OH– o el F–.
La nucleofilicidad define qué tan fuerte es el carácter nucleófilo de una especie. Este depende de muchos factores, pero los más importantes son el impedimento estérico durante el ataque nucleofílico y la acción del solvente.
Mientras más pequeño sea el nucleófilo, más rápido y efectivo será su ataque al electrófilo. Asimismo, cuanto menores sean las interacciones entre el solvente y el nucleófilo, mayor será la rapidez con que este ataque al electrófilo. Por lo tanto, de acuerdo a esto, el I– tiene mayor nucleofilicidad que el F–.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- James Ashenhurst. (2020). The Three Classes of Nucleophiles. Recuperado de: masterorganicchemistry.com
- Professor Patricia Shapley. (2012). Nucleophiles and Electrophiles. University of Illinois. Recuperado de: butane.chem.uiuc.edu
- Wikipedia. (2020). Nucleophile. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Nucleophile Definition in Chemistry. Recuperado de: thoughtco.com
- Rachael Curtis. (05 de junio de 2019). Nucleophile. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
