¿Qué son las series espectrales?
Las series espectrales consisten en un conjunto de líneas de colores sobre fondo oscuro, o bien de franjas brillantes separadas por zonas oscuras que emite la luz proveniente de todo tipo de sustancias.
Estas líneas se visualizan con ayuda de un espectrómetro, aparato que consiste en un prisma o de una rejilla finamente dividida, capaz de separar las distintas componentes de la luz.
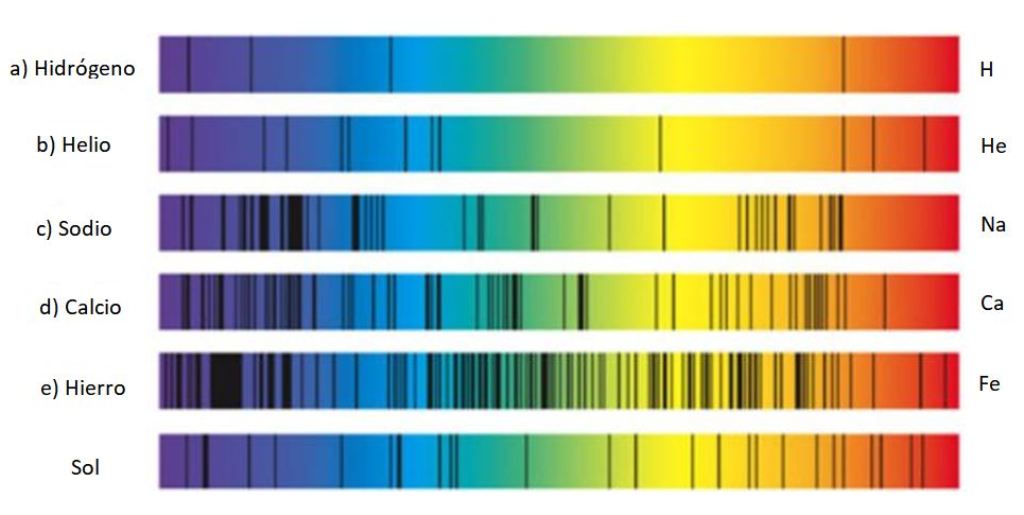
Dichos conjuntos de líneas reciben el nombre de espectro y cada sustancia tiene un espectro caracaterístico, una especie de huella digital que sirve para identificar su presencia en la luz que proviene de algún objeto. Ello se debe a que cada átomo tiene su propia configuración de electrones y niveles de energía permitidos.
Por eso encontrar las líneas espectrales es una técnica muy empleada por los astrónomos para averiguar la composición de las estrellas a a través de la luz que emiten. De hecho, todo lo que los astrónomos conocen acerca de las estrellas proviene de sus espectros, ya sea de emisión o absorción.
El origen de los espectros
La presencia de los espectros se debe a la configuración atómica. En efecto, los electrones se mantienen alrededor del núcleo en regiones llamadas orbitales, localizados a determinadas distancias discretas de él.
Por ejemplo en el hidrógeno, el elemento más sencillo, los radios orbitales vienen dados por 0.053∙n2 nanómetros, donde n = 1, 2, 3, 4,…. No se permiten valores intermedios entre estos, por eso se dice que los orbitales están cuantizados. También el estado energético de cada orbital está cuantizado.
Tales restricciones hace que los electrones se comporten al mismo tiempo como partículas y también como ondas, al igual que la luz. Sin embargo los electrones pueden ir de un orbital a otro, cambiando el estado energético del átomo.
Absorción y emisión de energía electromagnética
Por ejemplo, si un electrón va de un orbital más interno, con menor energía, a otro más externo y energético, es necesario que adquiera la energía electromagnética necesaria, la cual se almacena en el átomo. Este proceso se denomina absorción.
En cambio, si el electrón va de un orbital más externo hacia otro más interno, en la transición se emite un fotón, en forma de luz, que es la energía correspondiente a la diferencia de energía entre los orbitales. La longitud de onda corresponde a dicha diferencia y viene dada por:
- E es la energía
- λ es la longitud de onda
- h es la constante de Planck
- c es la velocidad de la luz
Tipos de espectros
Se producen espectros tanto de absorción como de emisión, lo cual depende de ciertos parámetros del objeto o sustancia, tales como la densidad y la temperatura. El espectro de un gas tenue es distinto del de un sólido a elevada temperatura.
Espectro continuo
Algunas fuentes emiten espectros cuyas líneas coloreadas cambian suavemente y contienen todos los colores. A esto se le llama espectro continuo, por ejemplo el que produce el filamento de un bulbo incandescenscente.
Espectro de emisión
Es el que emiten ciertas sustancias calientes y consiste en unas pocas líneas de determinada longitud de onda.
Este tipo de espectro es producido por gases tenues y calientes como los que llenan los tubos fluorescentes. La aurora boreal es otro ejemplo de emisión que se produce en los gases de la atmósfera superior terrestre. También producen espectros de emisión algunas nubes de gas interestelar.
Espectro de absorción
Este espectro es el que se recibe cuando la luz de un objeto denso y muy caliente se hace pasar a través de un gas más frío. En él se observan casi todos los colores, pero algunos aparecen disminuidos y surgen unas franjas oscuras en aquellas longitudes de onda que son absorbidas por los átomos o las moléculas del gas.
Leyes de Kirchoff de la espectroscopía
Las leyes de Kirchoff de la espectroscopía señalan bajo qué condiciones se forman los distintos espectros descritos anteriormente:
- Los espectros continuos: son emitidos por cualquier objeto a alta presión y temperatura.
- Los espectros de emisión: se producen por un gas caliente a baja presión, el cual emite líneas en longitudes de onda bien definidas, correspondientes a las transiciones electrónicas correspondientes a cada elemento que conforma el gas.
- Los espectros de absorción: son producidos por gases a bajas temperaturas situados cerca de fuentes de radiación continua. Los átomos o moléculas del gas absorben únicamente determinadas longitudes de onda.
El espectro de emisión del hidrógeno
Es particularmente importante el espectro de emisión del hidrógeno, ya que es el elemento más abundante en todo el universo y contiene mucha información importante acerca de las estrellas y la Vía Láctea.
Las series de líneas del espectro del hidrógeno fueron descubiertas por diversos investigadores y cada una lleva su nombre.
Serie de Balmer
El hidrógeno emite varías líneas en el espectro visible: cuando el electrón decae del orbital 3 al orbital 2 emite luz roja, cuya longitud de onda es de 656.6 nm, y si decae del orbital 4 al 2 entonces emite luz azul de 486.1 nm.

En 1885 (antes de que Bohr propusiera su teoría), el matemático y profesor suizo Johann Balmer (1825-1898) encontró por tanteo una fórmula para determinar las longitudes de onda λ de estas líneas:
Donde:
- R es la constante de Rydberg : 1.097 × 107 m-1
- n = 3, 4, 5 …., es decir, n ≥ 3 (entero).
Por ejemplo, para n = 3 en la ecuación de Balmer:
Correspondiente a la línea de color rojo a la derecha, mostrada en la figura de arriba. El descubrimiento de la serie de Balmer hizo que otros científicos se dedicaran a buscar líneas en el resto del espectro del hidrógeno y otros gases.
Serie de Lyman
Nótese que el espectro del hidrógeno mostrado en la figura contiene unas líneas en ultravioleta, las dos de la extrema izquierda, cuyas longitudes de onda son 397.0 nm y 388.9. nm.
En efecto, estas líneas en ultravioleta corresponden a la llamada serie de Lyman, descubiertas en 1906 por el físico Theodore Lyman. Su fórmula es:
Serie de Paschen
La serie de Paschen fue descubierta por el físico alemán Friederich Paschen en 1908 y es válida para n ≥ 4, es decir: n = 4, 5, 6…
Las líneas de Paschen se encuentran en la región del infrarrojo cercano y el nivel final es n = 3, es decir, sus valores ocurren cuando el electrón decae desde niveles superiores hasta n = 3. Como la serie de Lyman está en el ultravioleta, se concluye que la serie de Balmer se encuentra entre Lyman y Paschen.
Serie de Brackett
Esta serie descubierta en 1922 por Frederick Brackett, físico norteamericano, se ubica en el infrarrojo lejano y consiste en las líneas espectrales correspondientes a las transiciones del hidrógeno que comienzan en n = 5 y prosiguen:
Serie de Pfund
La serie de Pfund fue hallada en 1924 por el físico norteamericano August Hermann Pfund y se refiere a las transiciones que comienzan en n = 5, en la banda infrarrojo lejano:
- Arny, T. 2017. Explorations: An introduction to Astronomy. 8th. Ed. McGraw Hill.
- Bauer, W. 2011. Física para Ingeniería y Ciencias. Volumen 2. Mc Graw Hill.
- Chang, R. 2013. Química. 11va. Edición. Mc Graw Hill Educación.
- Sears, Zemansky. 2016. University Physics with Modern Physics. 14th. Ed. Volume 2. Pearson.
- Ventanas abiertas al universo. Las diferentes clases de espectros. Recuperado de: media4.obspm.fr.
