Inmunoglobulinas: concepto, estructura, tipos, funciones
¿Qué son las inmunoglobulinas?
Las inmunoglobulinas son moléculas que fabrican los linfocitos B y células plasmáticas que colaboran con la defensa del organismo. Consisten en una biomolécula de glucoproteína perteneciente al sistema inmunológico. Son una de las proteínas más abundantes del suero sanguíneo, después de la albumina.
Anticuerpo es otro nombre que reciben las inmunoglobulinas, y son consideradas globulinas debido a su comportamiento en la electroforesis del suero sanguíneo que las contiene. La molécula de inmunoglobulina puede ser simple o compleja, dependiendo de si su presentación es como monómero o se encuentra polimerizada.
La estructura común de las inmunoglobulinas es semejante a la letra “Y”. Existen cinco tipos de inmunoglobulinas que presentan diferencias morfológicas, funcionales y de ubicación en el organismo. Las diferencias estructurales de los anticuerpos no son de forma, sino en cuanto a su composición; cada tipo posee un objetivo específico.
La respuesta inmunológica que promueven las inmunoglobulinas es muy específica y es un mecanismo altamente complejo. El estímulo para su secreción por las células se activa en presencia de agentes extraños al organismo, como una bacteria. La función de la inmunoglobulina será unirse al elemento extraño y eliminarlo.
Las inmunoglobulinas o anticuerpos pueden estar presentes tanto en la sangre como en la superficie membranosa de los órganos. Estas biomoléculas representan elementos importantes dentro del sistema de defensas del cuerpo humano.
Estructura de las inmunoglobulinas
La estructura de los anticuerpos contiene aminoácidos y carbohidratos, los oligosacáridos. La presencia predominante de aminoácidos, su cantidad y distribución es lo que determina la estructura de la inmunoglobulina.
Como toda proteína, las inmunoglobulinas poseen estructura primaria, secundaria, terciaria y cuaternaria, determinando su aspecto típico.
Atendiendo al número de aminoácidos que presentan, las inmunoglobulinas poseen dos tipos de cadena: cadena pesada y cadena ligera. Además, de acuerdo con la secuencia de aminoácidos en su estructura, cada una de las cadenas tiene una región variable y una región constante.
Cadenas pesadas
Las cadenas pesadas de las inmunoglobulinas corresponden a unidades polipeptídicas constituidas por secuencias de 440 aminoácidos.
Cada inmunoglobulina posee 2 cadenas pesadas, y cada una de estas tiene a su vez una región variable y una región constante. La región constante tiene 330 aminoácidos y la variable 110 aminoácidos secuenciados.
La estructura de la cadena pesada es diferente para cada inmunoglobulina. Son un total de 5 tipos de cadena pesada que determinan los tipos de inmunoglobulina.
Los tipos de cadena pesada se identifican con las letras griegas γ, μ, α, ε, δ para las inmunoglobulinas IgG, IgM, IgA, IgE e IgD, respectivamente.
La región constante de las cadenas pesadas ε y μ están formadas por cuatro dominios, mientras que las que corresponden a α, γ, δ tienen tres. Entonces, cada región constante será diferente para cada tipo de inmunoglobulina, pero común a las inmunoglobulinas de un mismo tipo.
La región variable de la cadena pesada se encuentra formada por un único dominio de inmunoglobulina. Esta región posee una secuencia de 110 aminoácidos, y será diferente dependiendo de la especificidad del anticuerpo por un antígeno.
En la estructura de las cadenas pesadas puede observarse una angulación o flexión —denominada bisagra— que representa el área flexible de la cadena.
Cadenas ligeras
Las cadenas ligeras de las inmunoglobulinas son polipéptidos constituidos por unos 220 aminoácidos. Existen dos tipos de cadena ligera en el ser humano: kappa (κ) y lambda (λ), esta última con cuatro subtipos. Los dominios constante y variable poseen secuencias de 110 aminoácidos cada uno.
Un anticuerpo puede tener dos cadenas ligeras κ (κκ) o un par de cadenas λ (λλ) pero no es posible que posea una de cada tipo al mismo tiempo.
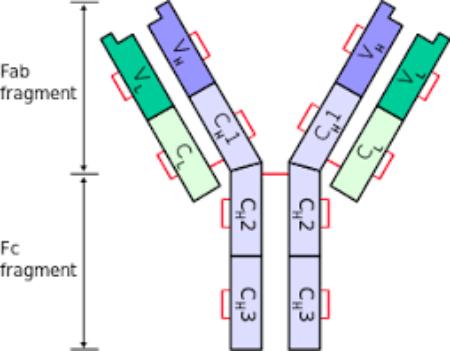
Segmentos Fc y Fab
Como cada inmunoglobulina tiene una forma parecida a una “Y” se puede dividir en dos segmentos. El segmento “inferior”, la base, se denomina fracción cristalizable o Fc; mientras que los brazos de la “Y” forman el Fab, o fracción que une al antígeno. Cada una de estas secciones estructurales de la inmunoglobulina desempeña una función diferente.
Segmento Fc
El segmento Fc posee dos o tres dominios constantes de las cadenas pesadas de la inmunoglobulina.
El Fc puede unirse a proteínas o un receptor específico en los basófilos, eosinófilos o células cebadas, por lo que induce la respuesta inmunológica específica que eliminará al antígeno. Fc corresponde al extremo carboxilo de la inmunoglobulina.
Segmento Fab
La fracción o segmento Fab de un anticuerpo contiene los dominios variables en sus extremos, además de los dominios constantes de las cadenas pesada y ligera.
El dominio constante de la cadena pesada se continúa con los dominios del segmento Fc formando la bisagra. Corresponde al extremo amino-terminal de la inmunoglobulina.
La importancia del segmento Fab es que permite la unión con los antígenos, substancias extrañas y potencialmente nocivas.
Los dominios variables de cada inmunoglobulina garantizan su especificidad por un antígeno determinado; esta característica permite incluso su uso en el diagnóstico de enfermedades inflamatorias e infecciosas.
Tipos de inmunoglobulinas
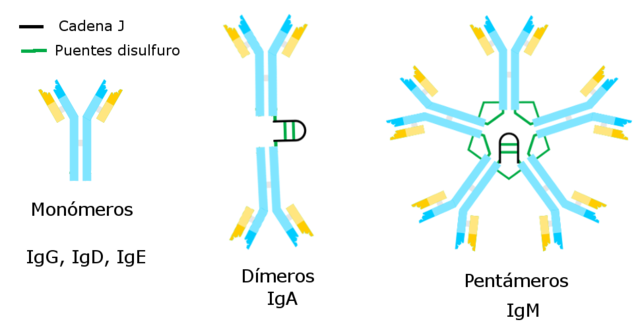
Las inmunoglobulinas conocidas hasta ahora poseen una cadena pesada específica que es constante para cada una de estas y la diferencia de las otras.
Existen cinco variedades de cadenas pesadas que determinan cinco tipos de inmunoglobulinas, cuyas funciones son diferentes.
Inmunoglobulina G (IgG)
La inmunoglobulina G es la variedad más numerosa. Posee una cadena pesada gamma y se presenta en forma unimolecular o monomérica.
La IgG es la más abundante tanto en suero sanguíneo como en el espacio tisular. Cambios mínimos en la secuencia de aminoácidos de su cadena pesada determinan su división en subtipos: 1, 2, 3 y 4.
La inmunoglobulina G posee una secuencia de 330 aminoácidos en su segmento Fc y un peso molecular de 150 000, de los cuales 105 000 corresponden a su cadena pesada.
Inmunoglobulina M (IgM)
La inmunoglobulina M es un pentámero cuya cadena pesada es μ. Su peso molecular es alto, aproximadamente 900 000.
La secuencia de aminoácidos de su cadena pesada es de 440 en su fracción Fc. Se encuentra predominantemente en el suero sanguíneo, representando un 10 a 12 % de las inmunoglobulinas. IgM posee un solo subtipo.
Inmunoglobulina A (IgA)
Le corresponde la cadena pesada tipo α, y representa el 15 % del total de inmunoglobulinas. IgA se encuentra tanto en sangre como en secreciones, incluso en la leche materna, presentando en forma de monómero o dímero. El peso molecular de esta inmunoglobulina es de 320 000 y presenta dos subtipos: IgA1 e IgA2.
Inmunoglobulina E (IgE)
La inmunoglobulina E está constituida por la cadena pesada tipo ε y es muy escasa en el suero, alrededor del 0,002 %.
IgE tiene un peso molecular de 200 000 y está presente como monómero principalmente en el suero, moco nasal y saliva. También es frecuente encontrar esta inmunoglobulina dentro de los basófilos y mastocitos.
Inmunoglobulina D (IgD)
La variedad de cadena pesada δ corresponde a la inmunoglobulina D, que representa el 0,2 % del total de inmunoglobulinas. IgD posee un peso molecular de 180 000 y se encuentra estructurada en forma de monómero.
Se encuentra relacionada con los linfocitos B, adherida en la superficie de estos. Sin embargo, la función de la IgD no es clara.
Cambio de tipo
Las inmunoglobulinas pueden experimentar un cambio estructural de tipo, debido a la necesidad de defensa contra un antígeno.
Este cambio se debe a la función de los linfocitos B de fabricar anticuerpos mediante la propiedad de inmunidad adaptativa. El cambio estructural es en la región constante de la cadena pesada, sin alterar la región variable.
Un cambio de tipo o de clase puede hacer que una IgM pase a IgG o IgE, y esto ocurre como una respuesta inducida por interferón gamma o interleucinas IL-4 e IL-5.
Funciones de las inmunoglobulinas
El rol que desempeñan las inmunoglobulinas en el sistema inmunológico es de vital importancia para la defensa del organismo.
Las inmunoglobulinas forman parte del sistema inmunológico humoral; es decir, son substancias secretadas por células para la protección contra agentes patógenos o nocivos.
Proporcionan un efectivo medio de defensa, efectivo, específico y sistematizado, siendo de gran valor como parte del sistema inmunológico. Poseen funciones generales y específicas dentro de la inmunidad:
Funciones generales
Los anticuerpos o inmunoglobulinas cumplen tanto funciones independientes como activando respuestas efectoras y secretoras mediadas por células.
Unión antígeno-anticuerpo
Las inmunoglobulinas tienen la función de unirse a los agentes antigénicos de manera específica y selectiva.
La formación del complejo antígeno-anticuerpo es la principal función de una inmunoglobulina y, por lo tanto, es la respuesta inmunológica que puede detener la acción del antígeno. Cada anticuerpo puede unirse a dos o más antígenos al mismo tiempo.
Funciones efectoras
La mayoría de las veces el complejo antígeno-anticuerpo sirve de inicio para activar respuestas celulares específicas o iniciar una secuencia de eventos que determinan la eliminación del antígeno. Las dos respuestas efectoras más comunes son la unión a células y la activación del complemento.
La unión celular depende de la presencia de receptores específicos para el segmento Fc de la inmunoglobulina, una vez que esta se haya unido al antígeno.
Células como los mastocitos, los eosinófilos, los basófilos linfocitos y los fagocitos poseen estos receptores y aportan los mecanismos para eliminación del antígeno.
La activación de la cascada del complemento es un mecanismo complejo que supone el inicio de una secuencia, por lo que el resultado final es secreción de sustancias tóxicas que eliminan a los antígenos.
Funciones específicas
En primer lugar, cada tipo de inmunoglobulina desarrolla una función de defensa específica:
Inmunoglobulina G
– La inmunoglobulina G provee la mayor parte de las defensas contra los agentes antigénicos, incluyendo bacterias y virus.
– IgG activa mecanismos como el complemento y la fagocitosis.
– La constitución de IgG específica para un antígeno es duradera.
– El único anticuerpo que la madre puede transferir a los hijos durante la gestación es la IgG.
Inmunoglobulina M
– La IgM es el anticuerpo de respuesta rápida ante los agentes nocivos e infecciosos, ya que provee una acción inmediata hasta ser substituida por la IgG.
– Este anticuerpo activa respuestas celulares incorporadas a la membrana de los linfocitos y respuestas humorales como el complemento.
– Es la primera inmunoglobulina que sintetiza el ser humano.
Inmunoglobulina A
– Actúa como barrera de defensa contra patógenos, al ubicarse en las superficies de las mucosas.
– Está presente en mucosa respiratoria, aparato digestivo, tracto urinario y también en secreciones como saliva, moco nasal y lágrimas.
– Aunque su activación del complemento es baja, puede asociarse con lisozimas para eliminar bacterias.
– La presencia de inmunoglobulina D tanto en la leche materna como en el calostro permite que un recién nacido pueda adquirirla durante la lactancia.
Inmunoglobulina E
– La inmunoglobulina E provee un fuerte mecanismo de defensa contra antígenos productores de alergia.
– La interacción entre IgE y un alérgeno hará que aparezcan sustancias inflamatorias responsables de los síntomas de las alergias, como estornudos, tos, urticaria, aumento de lágrimas y moco nasal.
– La IgE además puede acoplarse a la superficie de los parásitos por medio de su segmento Fc, produciendo una reacción que produce la muerte de estos.
Inmunoglobulina D
– La estructura monomérica de IgD se encuentra unida a linfocitos B que no han interactuado con antígenos, por lo que desempeñan la función de receptores.
– La función de IgD es poco clara.
