Ácido hipocloroso (HClO): estructura, propiedades, usos, síntesis
El ácido hipocloroso es un compuesto inorgánico cuya fórmula química es HClO. Corresponde al menos oxidado de los oxoácidos del cloro, pues contiene solo un átomo de oxígeno. De él derivan el anión hipoclorito, ClO–, y sus sales, ampliamente utilizadas como desinfectantes comerciales de agua.
El HClO es el agente oxidante y antimicrobiano más fuerte de los que se generan cuando el cloro gaseoso se disuelve en agua. Su acción antiséptica se conoce desde hace más de un siglo, incluso antes de que se usaran las disoluciones de cloro para limpiar las heridas de los soldados en la Primera Guerra Mundial.
Su descubrimiento de hecho se remonta al año 1834, por el químico francés Antoine Jérôme Balard, quien logró la oxidación parcial del cloro burbujeándolo en una suspensión acuosa de óxido de mercurio, HgO. Desde entonces, se ha venido usando como desinfectante y un agente antiviral.
Químicamente hablando, el HClO es un agente oxidante que termina cediendo su átomo de cloro a otras moléculas; es decir, con él puede sintetizarse compuestos clorados, siendo las cloroaminas de gran relevancia en el desarrollo de nuevos antibióticos.
En la década de los 70, se descubrió que el cuerpo es capaz de producir naturalmente este ácido mediante la acción de la enzima mieloperoxidasa; enzima que actúa sobre los peróxidos y aniones cloruro durante la fagocitosis. Así pues, del mismo organismo puede surgir este “asesino” de intrusos, pero a una escala inofensiva para su propio bienestar.
Índice del artículo
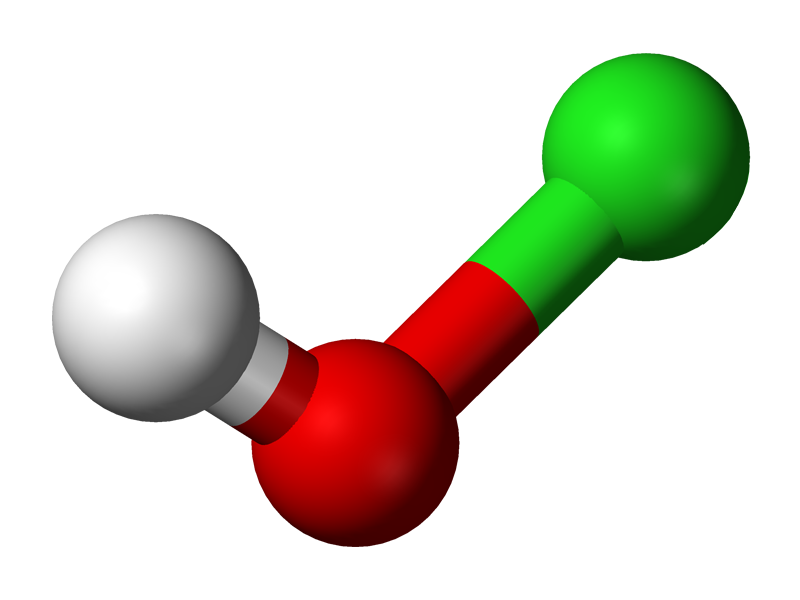
En la imagen superior se muestra la estructura del HClO. Nótese que la fórmula contradice la estructura: la molécula es H-O-Cl y no H-Cl-O; sin embargo, se suele preferir esta última para poder compararlo directamente con sus homólogos más oxidados: HClO2, HClO3 y HClO4.
El hidrógeno ácido, H+, liberado por el HClO se ubica en el grupo OH enlazado al átomo de cloro. Nótese además las notables diferencias de longitud en los enlaces O-H y Cl-O, siendo este último el más largo debido al menor grado de solapamiento de los orbitales del cloro, más difusos, con los del oxígeno.
La molécula HOCl apenas puede mantenerse estable en condiciones normales; no puede aislarse de sus disoluciones acuosas sin desproporcionarse o liberarse como cloro gaseoso, Cl2.
Por lo tanto, no existen cristales anhidros (ni siquiera hidratos de los mismos) del ácido hipocloroso; y hasta la fecha, tampoco hay indicios de que puedan prepararse por métodos extravagantes. De poder cristalizar, las moléculas de HClO interaccionarían unas con otras mediante sus dipolos permanentes (orientadas las cargas negativas hacia el oxígeno).
El HClO es un ácido monoprótico; es decir, solamente puede donar un H+ al medio acuoso (que es en donde se forma):
HClO(ac) + H2O ↔ ClO–(ac) + H3O+(ac) (pKa = 7,53)
De esta ecuación de equilibrio se observa que una disminución de los iones H3O+ (un aumento de la basicidad del medio), favorece la formación de más aniones hipocloritos, ClO–. En consecuencia, si se desea mantener relativamente estable una solución de ClO– es necesario que el pH sea básico, lo cual se logra con NaOH.
Su constante de disociación, pKa, deja entredicho que el HClO es un ácido débil. Por lo tanto, al manipularlo concentrado no habría que preocuparse tanto por los iones H3O+, sino por el HClO en sí mismo (dada su alta reactividad y no por su corrosividad).
Se hizo mención que el átomo de cloro en el HClO tiene un número de oxidación de +1. Esto significa que apenas requiere la ganancia de un solo electrón para volver a su estado basal (Cl0) y poder formar la molécula Cl2. En consecuencia, el HClO se reducirá a Cl2 y H2O, oxidando a otra especie con mayor rapidez en comparación al mismo Cl2 o ClO–:
2HClO(ac) + 2H+ + 2e– ↔ Cl2(g) + 2H2O(l)
Ya esta reacción permite entrever qué tan estable es el HClO en sus disoluciones acuosas.
Su poder oxidante no solo se mide por la formación de Cl2, sino también por su capacidad de ceder su átomo de cloro. Por ejemplo, puede reaccionar con especies nitrogenadas (entre ellas el amoníaco y bases nitrogenadas), para originar cloroaminas:
HClO + N-H → N-Cl + H2O
Nótese que se rompe un enlace N-H, de un grupo amino (-NH2) en su mayoría, y se sustituye por uno N-Cl. Lo mismo sucede con los enlaces O-H de los grupos hidroxilo:
HClO + O-H → O-Cl + H2O
Estas reacciones son cruciales y explican la acción desinfectante y antibacteriana del HClO.
El HClO es inestable casi por donde se le mire. Por ejemplo, el anión hipoclorito se desproporciona en especies de cloro con números de oxidación de -1 y +5, más estables que el de +1 en el HClO (H+Cl+O2-):
3ClO–(ac) ↔ 2Cl–(ac) + ClO3–(ac)
Esta reacción volvería a desplazar el equilibrio hacia la desaparición del HClO. Asimismo, el HClO participa directamente en un equilibrio paralelo con el agua y el gas cloro:
Cl2(g) + H2O(l) ↔ HClO(ac) + H+(ac) + Cl–(ac)
Es por eso que intentar calentar una disolución de HClO para concentrarlo (o aislarlo) conlleva a la producción de Cl2, el cual se identifica por ser un gas de color amarillo. Asimismo, estas disoluciones no pueden exponerse a la luz por demasiado tiempo, ni a la presencia de óxidos metálicos, pues descomponen el Cl2 (desaparece todavía más el HClO):
2Cl2 + 2H2O → 4HCl + O2
El HCl reacciona con el HClO para generar más Cl2:
HClO + HCl → Cl2 + H2O
Y así sucesivamente hasta que no haya más HClO.
Ya se ha explicado implícitamente uno de los métodos para preparar o sintetizar ácido hipocloroso: disolviendo cloro gaseoso en agua. Otro método bastante similar consiste en disolver en agua el anhídrido de este ácido: el monóxido de dicloro, Cl2O:
Cl2O(g) + H2O(l) ↔ 2HClO(ac)
Nuevamente no hay cómo aislar el HClO puro, pues evaporar el agua desplazaría el equilibrio a la formación de Cl2O, gas que escaparía del agua.
Por otro lado, se ha logrado preparar disoluciones más concentradas de HClO (al 20%) utilizando el óxido de mercurio, HgO. Para ello, se disuelve el cloro en un volumen de agua justo en su punto de congelación, de tal manera que se obtiene un hielo clorado. Luego, este mismo hielo se agita, y mientras se derrite, se mezcla con el HgO:
2Cl2 + HgO + 12H2O → 2HClO + HgCl2 + 11H2O
La disolución de HClO al 20% puede finalmente destilarse al vacío.
Un método más simple y seguro para preparar las disoluciones de ácido hipocloroso consiste en utilizar las salmueras como materia prima en lugar del cloro. Las salmueras son ricas en aniones cloruros, Cl–, los cuales mediante un proceso de electrólisis pueden oxidarse a Cl2:
2H2O → O2 + 4H+ + 4e−
2Cl− ↔ 2e− + Cl2
Estas dos reacciones ocurren en el ánodo, donde se produce el cloro que inmediatamente se disuelve para originar HClO; mientras que en el compartimiento del cátodo, el agua se reduce:
2H2O + 2e− → 2OH− + H2
De esta manera puede sintetizarse el HClO a escala comercial a industrial; y estas disoluciones obtenidas a partir de salmueras son, de hecho, los productos disponibles en el mercado de este ácido.
El HClO puede utilizarse como un agente oxidante para oxidar alcoholes a cetonas, y para sintetizar cloroaminas, cloroamidas, o clorhidrinas (partiendo de los alquenos).
No obstante, todos sus demás usos pueden englobarse en una palabra: biocida. Es un asesino de hongos, bacterias, virus, y un neutralizador de las toxinas liberadas por los agentes patógenos.
El sistema inmune de nuestro cuerpo sintetiza su propio HClO por la acción de la enzima mieloperoxidasa, ayudando a los glóbulos blancos a erradicar los intrusos que causan la infección.
Infinidades de estudios plantean diversos mecanismos de la acción del HClO sobre la matriz biológica. Este dona su átomo de cloro a los grupos aminos de ciertas proteínas, y también oxida sus grupos SH presentes a puentes disulfuros S-S, trayendo como consecuencia la desnaturalización de las mismas.
Asimismo, detiene la replicación del ADN al reaccionar con las bases nitrogenadas, afecta la completa oxidación de la glucosa, y además puede llegar a deformar la membrana celular. Todas estas acciones terminan provocando la muerte a los gérmenes.
Es por eso que las disoluciones de HClO terminan siendo utilizadas para:
-Tratamiento de heridas infecciosas y gangrenas
-Desinfectar suministros de agua
-Agente esterilizante de material quirúrgico, o herramientas empleadas en veterinaria, medicina y odontología
-Desinfectante de cualquier tipo de superficie u objeto en general: barras, pasamanos, máquinas de café, cerámicas, mesas de vidrio, mesones de laboratorio, etc.
-Sintetizar cloroaminas que sirvan como antibióticos menos agresivos, pero a la vez más duraderos, específicos y estables que el mismo HClO
Las disoluciones de HClO pueden ser peligrosas si están muy concentradas, ya que pueden reaccionar violentamente con especies propensas a oxidarse. Además, tienden a liberar cloro gaseoso al desestabilizarse, por lo que deben ser almacenadas bajo un riguroso protocolo de seguridad.
El HClO es tan reactivo hacia los gérmenes, que donde se riega desaparece en el acto, sin representar un riesgo después para quienes tocan las superficies tratadas por él. Igual sucede en el interior del organismo: se descompone prontamente, o es neutralizado por cualquier especie del entorno biológico.
Al generarlo el propio organismo, es presumible que este puede tolerar bajas concentraciones de HClO. No obstante, si está muy concentrado (utilizado para fines sintéticos y no desinfectantes) puede acarrear efectos indeseables al atacar también a las células sanas (de la piel, por ejemplo).
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Gottardi, W., Debabov, D., & Nagl, M. (2013). N-chloramines, a promising class of well-tolerated topical anti-infectives. Antimicrobial agents and chemotherapy, 57(3), 1107–1114. doi:10.1128/AAC.02132-12
- By Jeffrey Williams, Eric Rasmussen & Lori Robins. (06 de octubre de 2017). Hypochlorous Acid: Harnessing an Innate Response. Recuperado de: infectioncontrol.tips
- Hydro Instruments. (s.f.). Basic Chemistry of Chlorination. Recuperado de: hydroinstruments.com
- Wikipedia. (2019). Hypochlorous acid. Recuperado de: en.wikipedia.org
- Serhan Sakarya et al. (2014). Hypochlorous Acid: An Ideal Wound Care Agent With Powerful Microbicidal, Antibiofilm, and Wound Healing Potency. HMP Wounds. Recuperado de: woundsresearch.com
- PrebChem. (2016). Preparation of hypochlorous acid. Recuperado de: prepchem.com
