Ribulosa-1,5-bifosfato (RuBP): características, carbolixación
La ribulosa-1,5-bifosfato, abreviada comúnmente RuBP, es una molécula biológica que actúa como sustrato en el ciclo de Calvin de la fotosíntesis, siendo esta la molécula sobre la cual se fija el CO2.
En este proceso la RuBP puede ser oxigenada o carboxilada, dando paso a la síntesis de hexosas y atravesando varias reacciones hasta su propia regeneración (reciclaje). La carboxilación y oxidación de la RuBP es realizada por la misma enzima: ribulosa-1,5-bifosfato carboxilasa/oxigenasa (RuBisCO o Rubisco). En la regeneración de esta molécula ocurre la fosforilación de ribulosa-5-fosfato por la enzima fosforibuloquinasa.
Índice del artículo
- 1 Características
- 2 Carboxilación de la RuBP
- 3 RuBP en la formación de glucosa
- 4 Regeneración de la RuBP
- 5 La RuBP puede ser oxigenada
- 6 Mecanismos para evitar la oxigenación de la RuBP
- 7 Referencias
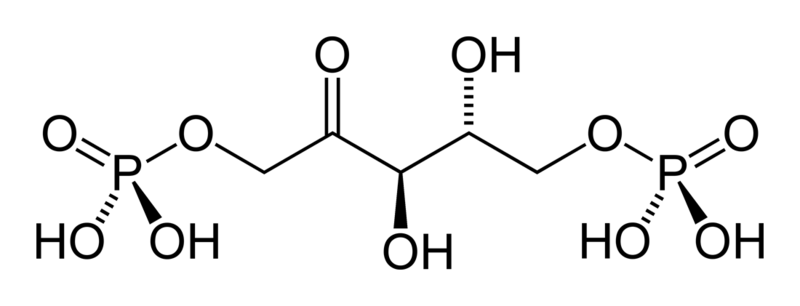
La RuBP es una molécula del tipo cetopentosa. Estos monosacáridos se caracterizan, como su nombre lo indica, por presentar cinco carbonos con un grupo cetónico, es decir, un grupo carbonilo en uno de los carbonos centrales.
Como en la mayoría de las cetosas, el grupo carbonilo se encuentra en el C2, mientras que en los carbonos C3 y C4 se encuentran grupos hidroxilo. La RuBP es un derivado de la ribulosa, donde los carbonos C1 y C5 también cuentan con grupos hidroxilo. En la RuBP estos carbonos (C1 y C5) se encuentran activados por dos grupos fosfatos ubicados en los sitios respectivos.
En la primera etapa del ciclo de Calvin, una enzima llamada fosforribuloquinasa produce la fosforilación de la ribulosa-5-fosfato para generar RuBP. Posteriormente ocurre la carboxilación, por acción de la enzima Rubisco.
En la carboxilación de la RuBP, esta actúa como aceptora de CO2, uniéndose a dicha molécula para formar dos moléculas de 3-fosfoglicerato (3PG). Durante esta reacción se forma un intermediario endiolato por la toma del protón del carbono C3 de la RuBP.
El endiolato genera un ataque nucleofílico sobre el CO2 formando un β-oxoácido que es rápidamente atacado por H2O en su carbono C3. El producto de este ataque sufre una reacción muy similar a una rotura aldólica, generando dos moléculas de 3PG, una de las cuales porta el carbono proveniente del CO2.
La enzima Rubisco que lleva a cabo esta reacción, es una enzima de gran tamaño, conformada por ocho subunidades iguales. Esta enzima se considera como una de las proteínas más abundantes sobre la tierra, representando aproximadamente el 15% del total de las proteínas dentro de los cloroplastos.
Como su nombre lo indica (Ribulosa bifosfato carboxilasa/oxigenasa), la Rubisco puede catalizar tanto la carboxilación como la oxidación de la RuBP, pudiendo reaccionar tanto con CO2 como con O2.
En las plantas verdes, la fotosíntesis produce ATP y NADPH en la fase luminosa. Estas moléculas son usadas para llevar a cabo la reducción del CO2 y formar productos reducidos como glúcidos, en su mayoría almidón y celulosa.
Como se ha mencionado, en la fase oscura de la fotosíntesis, ocurre la escisión de la RuBP por acción de la Rubisco, con una relación de dos moléculas de 3PG formadas por cada RuBP. Al completarse seis vueltas del ciclo de Calvin ocurre la formación de una hexosa (ej glucosa).
En las seis vueltas de este ciclo, seis moléculas de CO2 reaccionan con seis de RuBP para formar 12 moléculas de 3PG. Estas moléculas son transformadas en 12 BPG (1,3-bifosfoglicerato) y luego en 12 GAP.
De estas 12 moléculas de GAP, cinco son isomerizadas hasta DHAP de las cuales tres reaccionan con tres moléculas más de GAP para formar tres fructosa-1,6-bifosfato. Estas últimas son desfosforiladas hasta fructosa-6-fosfato (F6P) por acción de la enzima hexosadifosfatasa.
Finalmente, una glucosafosfato isomerasa convierte a una de las tres moléculas de F6P en glucosa-6-fosfato, que es desfosforilada por su respectiva fosfatasa hasta glucosa, completándose así la ruta de la formación de una hexosa a partir de CO2.
En la ruta descrita previamente, las moléculas de GAP formadas pueden dirigirse hacia la formación de una hexosa o hacia la regeneración de la RuBP. Por cada vuelta de la fase oscura de la fotosíntesis, una molécula de RuBP reacciona con una de CO2 para finalmente regenerar una RuBP.
Como se ha descrito en la sección anterior, por cada seis vueltas del ciclo de Calvin se forman 12 moléculas de GAP, de las cuales ocho están involucradas en la formación de una hexosa, quedando cuatro disponibles para la regeneración de RuBP.
Dos de estas cuatro GAP reaccionan con dos F6P por acción de una transcetolasa para formar dos xilulosas y dos eritrosas. Estas últimas se unen a dos moléculas de DHAP para producir dos carbohidratos de siete carbonos, la sedoheptulosa-1,7-bifosfato.
Las sedoheptulosa-1,7-bifosfato son desfosforiladas para luego reaccionar con los últimos dos GAP y formar dos xilulosas y dos ribosa-5-fosfato. Estas últimas son isomerizadas hasta ribulosa-5-fosfato. Por otro lado, las xilulosas, por acción de una epimerasa, son transformadas en cuatro ribulosas más.
Finalmente, las seis ribulosas-5-fosfato formadas son fosforiladas por la fosforribuloquinasa para dar lugar a seis RuBP.
La fotorrespiración es un proceso de respiración “lumínica” que ocurre junto a la fotosíntesis, siendo muy activo en las plantas de tipo C3 y casi ausente en las plantas C4. Durante este proceso las moléculas de RuBP no son reducidas, por lo que no ocurre la biosíntesis de hexosas, ya que el poder reductor se desvía hacia la reducción del oxígeno.
La Rubisco ejerce su actividad oxigenasa en este proceso. Esta enzima presenta una baja afinidad hacia el CO2, además de ser inhibida por el oxígeno molecular presente en las células.
Debido a esto, cuando las concentraciones celulares de oxígeno son mayores que las de CO2, el proceso de la fotorrespiración puede superar la carboxilación de la RuBP por CO2. A mediados del siglo XX esto quedó demostrado al observar que las plantas iluminadas fijaban O2 y liberaban CO2.
En la fotorrespiración la RuBP reacciona con O2 por acción de la Rubisco, formando un intermediario endiolato que produce 3PG y fosfoglicolato. Este último es hidrolizado por acción de una fosfatasa, originando glicolato que posteriormente es oxidado por una serie de reacciones que ocurren en los peroxisomas y mitocondrias, rindiendo finalmente el CO2.
La fotorrespiración es un mecanismo que interfiere con el proceso de fotosíntesis, deshaciendo parte de su trabajo, por el hecho de liberar CO2 y utilizar los sustratos necesarios para la producción de las hexosas, disminuyendo así la velocidad de crecimiento de las plantas.
Algunas plantas han logrado evitar los efectos negativos de la oxigenación de la RuBP. En las plantas C4 por ejemplo, ocurre la fijación previa del CO2, concentrando al mismo en las células fotosintéticas.
En este tipo de plantas el CO2 se fija en las células mesófilas que carecen de Rubisco, por condensación con la fosfoenolpiruvato (PEP), produciendo oxalacetato que se transforma en malato y pasa a las células envolventes del haz, donde libera el CO2 que entra finalmente al ciclo de Calvin.
Las plantas CAM, por otro lado, separan la fijación del CO2 y el ciclo de Calvin en el tiempo, es decir, llevan a cabo la captación del CO2 en las noches, a través de la apertura de sus estromas, almacenándolo mediante el metabolismo del ácido crasuláceo (CAM) a través de la síntesis del malato.
Al igual que en las plantas C4, el malato pasa a las células envolventes del haz para liberar el CO2.
- Berg, J. M., Stryer, L., & Tymoczko, J. L. (2007). Bioquímica. Reverté.
- Campbell, M. K., & Farrell, S. O. (2011). Biochemistry. Sixth edition. Thomson. Brooks/Cole.
- Devlin, T. M. (2011). Textbook of biochemistry. John Wiley & Sons.
- Koolman, J., & Röhm, K. H. (2005). Bioquímica: texto y atlas. Ed. Médica Panamericana.
- Mougios, V. (2006). Exercise biochemistry. Human Kinetics.
- Müller-Esterl, W. (2008). Bioquímica. Fundamentos para medicina y ciencias de la vida. Reverté.
- Poortmans, J.R. (2004). Principles of exercise biochemistry. Karger.
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana
