Sustitución nucleofílica aromática: efectos, ejemplos
La sustitución nucleofílica aromática (SNAr) es una reacción que ocurre en la química orgánica, la cual consiste en el desplazamiento de un buen grupo saliente por un nucleófilo entrante. Desde el punto de vista de su mecanismo y aspectos electrónicos, es la cara opuesta de la sustitución electrofílica aromática (SEAr).
Generalmente el grupo saliente se trata de un halógeno, el cual sale como anión haluro X–. Esta reacción solamente puede tomar lugar si el anillo aromático (el de benceno en su mayoría) se encuentra deficiente en electrones; es decir, si posee grupos sustituyentes atractores de electrones.

La imagen superior esquematiza lo dicho en el párrafo anterior. El grupo atractor de electrones EWG (por sus siglas en inglés: Electron Withdrawing Group), activa al anillo aromático para el ataque nucleofílico de la especie negativa Nu–. Puede verse que se forma un intermediario (en el centro), del cual se libera o sale el haluro X–.
Nótese que en términos simples X es substituido por Nu en un anillo aromático. Esta reacción es muy versátil y necesaria en la síntesis de nuevos fármacos, así como en estudios de química orgánica sintética.
Índice del artículo
El anillo aromático puede “cargarse” o “descargarse” de electrones en función de cuáles sean sus sustituyentes (los que reemplazan al enlace C-H original).
Cuando estos sustituyentes pueden donar densidad electrónica al anillo, se dice que lo enriquecen de electrones; si por el contrario son atractores de densidad electrónica (el EWG mencionado arriba), se dice entonces que empobrecen al anillo de electrones.
En cualquiera de los casos, el anillo se activa para una reacción aromática en específico, mientras que se desactiva para la otra.
Por ejemplo, un anillo aromático rico en electrones se dice que es activo para la sustitución electrofílica aromática; es decir, puede donar sus electrones a una especie electrófila, E+. Sin embargo, no donará electrones a una especie Nu–, ya que las cargas negativas se repelerían entre sí.
Ahora, si el anillo es pobre en electrones, no tiene cómo cederlos a la especie E+ (no ocurre la SEAr); en cambio, sí tiene disponibilidad de aceptar los electrones de la especie Nu– (se desarrolla la SNAr).
Aclarados los aspectos generales de entrada, pueden ahora enumerarse algunas diferencias entre la SNAr y la SEAr:
– El anillo aromático actúa como un electrófilo (deficiente de electrones) y es atacado por un nucleófilo.
– Se sustituye del anillo un grupo saliente X; no un H+
– No se forman carbocationes, sino intermediarios con una carga negativa que puede deslocalizarse por resonancia
– La presencia de más grupos atractores en el anillo aceleran la sustitución en vez de ralentizarla
– Finalmente, estos grupos no ejercen efectos directores sobre dónde (en cuál carbono) ocurrirá la sustitución. La sustitución ocurrirá siempre en el carbono enlazado al grupo saliente X.
El último punto se ilustra también en la imagen: el enlace C-X se rompe para formarse el nuevo enlace C-Nu.
Naturalmente, mientras más pobre en electrones sea el anillo, más rápida será la SNAr y menos drásticas serán las condiciones requeridas para que ocurra. Considere el siguiente ejemplo representado en la imagen inferior:
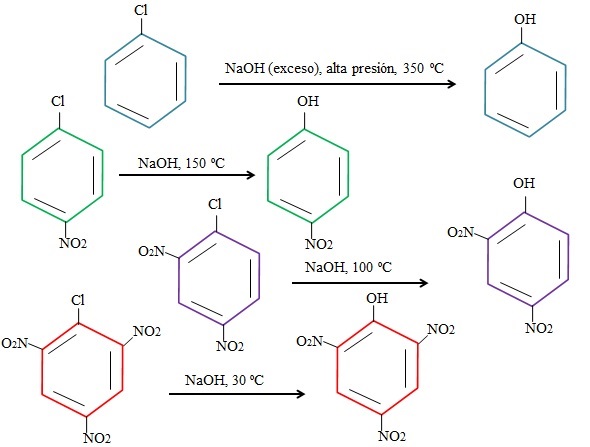
Nótese que el 4-nitroclorobenceno (anillo azul) requiere de condiciones drásticas (alta presión y una temperatura de 350 ºC) para que ocurra la sustitución del Cl por el OH. En este caso, el cloro es el grupo saliente (Cl–), y el hidróxido el nucleófilo (OH–).
Cuando aparece el grupo NO2, el cual es atractor de electrones (anillo verde), la sustitución puede llevarse a cabo a una temperatura de 150 ºC a presión ambiente. A medida que aumenta el número de grupos NO2 presentes (anillos morado y rojo), la sustitución toma lugar a temperaturas cada vez menores (100 ºC y 30ºC, respectivamente).
Por lo tanto, los grupos NO2 aceleran la SNAr y desproveen de electrones al anillo, volviéndolo más susceptible al ataque del OH–.
No se explicará aquí las posiciones relativas del Cl con respecto a NO2 en el 4-nitroclorobenceno, y cómo estas alteran la velocidad de la reacción; por ejemplo, las velocidades de reacción del 2-nitroclorobenceno y 3-nitroclorobenceno son diferentes, siendo la de este último la más lenta en comparación a los otros isómeros.
Retomando el 4-nitroclorobenceno, su reacción de substitución es más lenta si se le compara al de su homólogo fluorado:
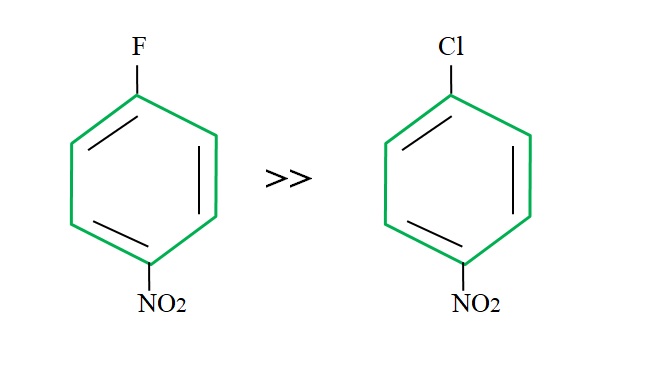
La explicación de esto no puede radicar en otra variable que la diferencia entre el F y Cl. El flúor es un pésimo grupo saliente, pues el enlace C-F es más difícil de romper que el enlace C-Cl. Por lo tanto, el rompimiento de este enlace no es el paso determinante de la velocidad para la SNAr, sino la adición del Nu– al anillo aromático.
El flúor por ser más electronegativo que el cloro, el átomo de carbono enlazado a él tiene mayor deficiencia electrónica (Cδ+-Fδ-). En consecuencia, el carbono del enlace C-F es mucho más susceptible de ser atacado por Nu– que el del enlace C-Cl. Es por eso que la sustitución de F por OH es mucho más rápida que la de Cl por OH.
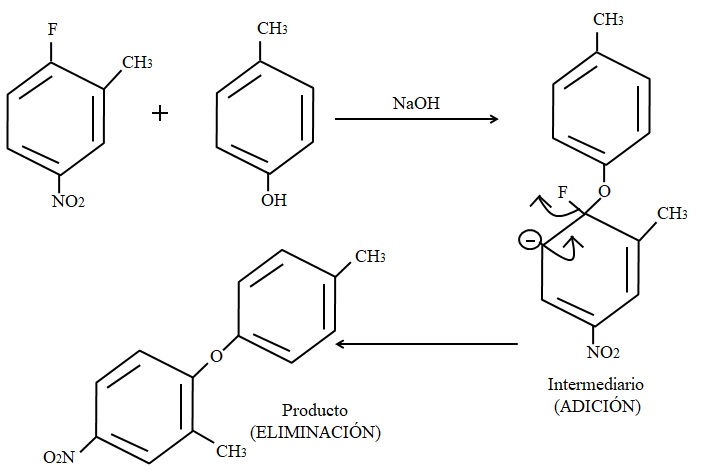
Para finalizar, se muestra a continuación un ejemplo de este tipo de reacciones orgánicas en la imagen superior. El para-cresol no da la apariencia de ser un nucleófilo; pero al haber un medio básico, se desprotona su grupo OH, quedando como un anión fenóxido, el cual sí ataca al 2-metil-4-nitrofluorbenceno.
Cuando ocurre este ataque, se dice que el nucleófilo se adiciona al electrófilo (el anillo aromático del 2-metil-4-nitrofluorbenceno). Este paso puede verse a la derecha de la imagen, donde se forma el compuesto intermediario con ambos sustituyentes pertenecientes al anillo.
Al adicionarse el para-cresol aparece una carga negativa que se deslocaliza por resonancia dentro del anillo (noten que deja de ser aromático).
En la imagen apenas se muestra la última estructura de resonancia, de la cual termina de salir el flúor como F–; pero en realidad dicha carga negativa llega a deslocalizarse incluso en los átomos de oxígeno del grupo NO2. Luego del paso de adición viene el de eliminación, el último, que es cuando se forma finalmente el producto.
El grupo NO2 remanente puede reducirse al grupo NH2, y de allí es posible realizar más reacciones de síntesis para modificar la molécula final. Esto pone de manifiesto el potencial sintético del SNAr, y que su mecanismo, además, consta de dos pasos: uno de adición y otro de eliminación.
Actualmente, sin embargo, hay pruebas experimentales y computacionales de que en realidad la reacción procede siguiendo un mecanismo concertado, donde ambos pasos ocurren simultáneamente mediante un complejo activado y no un intermediario.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2019). Nucleophilic aromatic substitution. Recuperado de: en.wikipedia.org
- James Ashenhurst. (06 de septiembre de 2019). Nucleophilic Aromatic Substitution (NAS). Recuperado de: masterorganicchemistry.com
- Chemistry LibreTexts. (05 de junio de 2019). Nucleophilic Aromatic Substitution. Recuperado de: chem.libretexts.org
