Erbio: estructura, propiedades, obtención, usos
El erbio es un elemento metálico perteneciente a las tierras raras, específicamente a los lantánidos, y cuyo símbolo químico es Er. Su nombre deriva de una villa sueca llamada Ytterby, y suele causar confusión porque se parece mucho al de otros elementos, tales como terbio (Tb) e iterbio (Yb), ambos también lantánidos.
El erbio participa con un estado de oxidación de +3 en la gran mayoría de sus compuestos, característica química bastante común entre los elementos lantánidos. Cuando estos compuestos, como el ErCl3, se disuelven en soluciones acuosas, muestran una coloración rosada; así como varios de sus sólidos, usados como aditivos para colorear vidrios, joyas o cerámicas.

La popularidad del erbio no es demasiado notable, aun ni entre los estudiantes de química. Sin embargo, quienes trabajan en las telecomunicaciones y con los cables de fibras ópticas, sabrán cuán importante es para amplificar las señales que viajan entre todos los continentes.
A pesar de ser uno de los metales de las tierras raras, el erbio posee una abundancia equiparable a la del tantalio y tungsteno. La demora por su obtención y producción se debió a los complicados procesos para separarlo de minerales tales como la gadolinita, la xenotima y la euxenita.
Índice del artículo
- 1 Descubrimiento
- 2 Estructura química del erbio
- 3 Configuración electrónica
- 4 Propiedades del erbio
- 5 Obtención
- 6 Usos/aplicaciones
- 7 Referencias
El erbio fue descubierto en 1843 por el químico sueco Carl Gustaf Mosander, quien estudiaba muestras del mineral gadolinita, recolectadas en las canteras de Ytterby, una villa ubicada en Suecia.
De la gadolinita aisló el óxido de itrio, Y2O3, y tras una serie de precipitaciones con hidróxido de amonio y calentamiento, obtuvo dos nuevos precipitados: los óxidos erbia y terbia.
Sin embargo, en 1860, luego de estudios espectroscópicos, se intercambiaron las identidades de los respectivos óxidos: erbia correspondía al óxido de terbio, mientras que terbia era el óxido del erbio.
Los átomos de erbio interaccionan entre sí utilizando los electrones de valencia de sus orbitales 4f y 6s, estableciendo por lo tanto un fuerte enlace metálico. Como resultado de este enlace, de sus radios atómicos, y del modo de sus empaquetamientos en los cristales, el erbio adopta una estructura hexagonal compacta, hcp, de carácter denso.
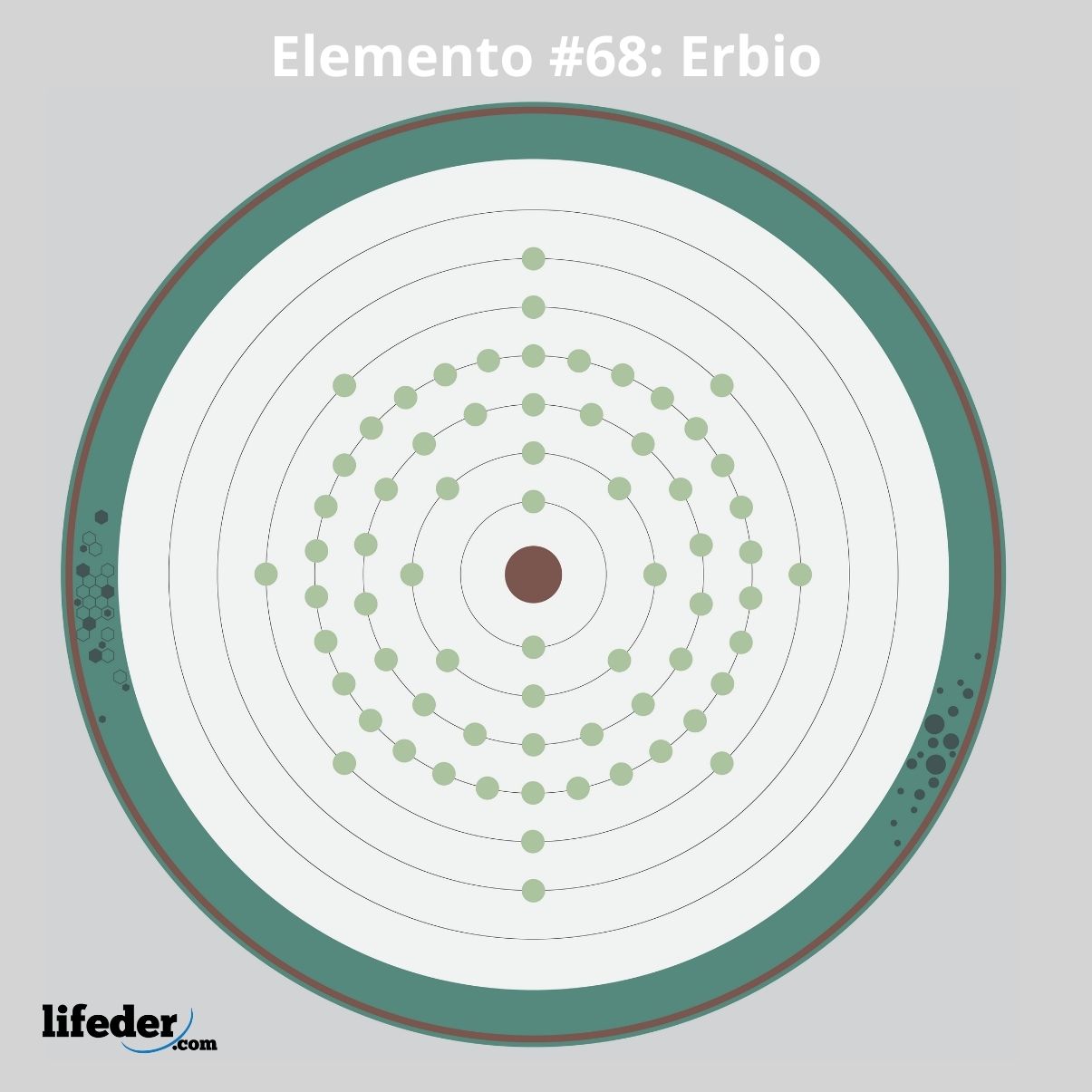
La configuración electrónica abreviada para el erbio es:
[Xe] 6s2 4f12
Tiene 12 electrones en sus orbitales 4f, lo cual indica que dicha configuración electrónica no corresponde a ninguna irregularidad o excepción al orden de llenado (principio de Aufbau).
Metal blanco plateado, blando, maleable, que se oxida lentamente cuando se expone al aire. Cuando se lima bruscamente, desprende chispas y destellos verdosos.
68
167.26 g/mol
1529 ºC
2868 ºC
A temperatura ambiente: 9.066 g/cm3
En el punto de fusión: 8.86 g/cm3
El estado de oxidación predilecto para el erbio, así como para otros lantánidos, es el +3 (Er3+). También puede tener estados de oxidación de 0 (Er0), +1 (Er+) y +2 (Er2+), siendo estos sin embargo menos comunes.
Paramagnético a temperatura ambiente. Es atraído débilmente por imanes.
1.24 en la escala de Pauling.
-Primera: 589.3 kJ/mol
-Segunda: 1150 kJ/mol
-Tercera: 2194 kJ/mol
El erbio reacciona para formar compuestos participando con un número de oxidación de +3. Por ejemplo, cuando una pieza metálica de erbio pierde su brillo, se debe a que una capa de su óxido recubre su superficie:
4 Er + 3 O2 → 2 Er2O3
Asimismo reacciona con el agua fría o caliente para formar su hidróxido:
2 Er + 6 H2O → 2 Er(OH)3 + 3 H2
Y directamente con todos los halógenos para dar lugar a sus respectivos haluros, cuya fórmula general es ErX3 (ErF3, ErCl3, etc.). Estos haluros, al igual que muchos de los compuestos de erbio (III), se distinguen porque sus sólidos presentan coloraciones rosadas o violetas, al igual que sus disoluciones acuosas, donde tenemos el acuo complejo [Er(OH2)9]3+.
Curiosamente, los compuestos de erbio conservan sus coloraciones rosadas solo si se mantienen expuestos al aire libre, recibiendo radiaciones UV del sol. De lo contrario, exhiben colores mates.

El erbio se encuentra en la naturaleza formando parte de muchos minerales de las tierras raras, entre ellos la monacita, las arcillas lateríticas, la bastnasita, la xenotima y la euxenita.
Estas dos últimas, junto con las arcillas del sureste de China, son las principales materias primas para la producción del erbio. China es el país que lidera, y por mucho, el suministro y mercado de los lantánidos.
Los iones Er3+, del óxido Er2O3, deben separarse del resto de la matriz mineralógica, compuesta por otros lantánidos (Eu3+, Sm3+, etc.). Hacer esto representaba un proceso engorroso y costoso; sin embargo, con el desarrollo de las técnicas de cromatografía de intercambio iónico fue posible la producción del erbio y otros metales.
Disolviendo entonces la xenotima o el mineral seleccionado en un medio ácido (HCl o H2SO4), y separando los iones Er3+ como Er2O3 o cualquiera de sus sales, se procede a una reducción utilizando vapores de potasio o de calcio, como agentes reductores, bajo una atmósfera inerte de argón. No fue sino hasta 1934 que se produjo la primera muestra considerablemente pura de erbio.
El color del óxido de erbio es aprovechado en las gemas sintéticas y en los objetos de vidrios para teñirlos de rosado.
Los átomos de erbio absorben la radiación infrarroja, por lo que se utilizan en los filtros fotográficos.
El erbio forma parte de los granates de itrio y aluminio (YAG), usándose para reproducir láseres con los cuales se rejuvenece la piel y se eliminan cicatrices, manchas o arrugas en tratamientos dermatológicos.
Los átomos de erbio se utilizan también como dopantes en las fibras ópticas, actuando como amplificadores de la luz cada 50 kilómetros de cable en los suelos oceánicos. Esto permite que la señal pueda surcar enormes distancias, gracias a lo cual es posible, por ejemplo, reproducir vídeos de Youtube de distintas partes del mundo.
Los fotones excitan los átomos de erbio en el vidrio, perdiendo energía y liberando más fotones, ocasionando que la intensidad de la luz que viaja a través de la fibra se duplique.
La capacidad que tienen los átomos de erbio de absorber la luz se aprovecha en las gafas de las soldaduras, las cuales contienen sales de erbio que absorben los deslumbrantes destellos, impidiendo así que el trabajador se lastime los ojos o quede ciego mientras suelda.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Erbium. Recuperado de: en.wikipedia.org
- Mohammad Reza Ganjali et al. (2016). Lanthanides Series Determination by Various Analytical Methods. ScienceDirect.
- The Editors of Encyclopaedia Britannica. (2020). Erbium. Recuperado de: britannica.com
- Dr. Doug Stewart. (2020). Erbium Element Facts. Recuperado de: chemicool.com
- National Center for Biotechnology Information. (2020). Erbium. PubChem Element Summary for Atomic Number 68. Recuperado de: pubchem.ncbi.nlm.nih.gov
