Calorimetría: qué estudia y aplicaciones
La calorimetría es una técnica que determina los cambios del contenido calórico de un sistema asociados con un proceso químico o físico. Se basa en la medición de los cambios de temperaturas cuando un sistema absorbe o emite calor. El calorímetro es el equipo que se utiliza en las reacciones en las que está involucrado un intercambio térmico.
El que se conoce como “taza de café” es la forma más simple de este tipo de aparato. Mediante su uso se mide la cantidad de calor involucrado en reacciones realizadas a presión constante en una disolución acuosa. Un calorímetro tipo taza de café consiste de un envase de poliestireno, el cual se coloca en un vaso de precipitado.
El agua se coloca en el envase de poliestireno, dotado de una tapa del mismo material que le confiere un cierto grado de aislamiento térmico. Además, el envase tiene un termómetro y un agitador mecánico.
En este calorímetro se mide la cantidad de calor que se absorbe o emite, dependiendo de si la reacción es endotérmica o exotérmica, cuando una reacción tiene lugar en una solución acuosa. El sistema a estudiar está constituido por los reactivos y los productos.
Índice del artículo
- 1 ¿Qué estudia la calorimetría?
- 2 Capacidad calórica de un calorímetro
- 3 Bomba calorimétrica
- 4 Tipos de calorímetro
- 5 Aplicaciones
- 6 Referencias
La calorimetría estudia la relación que tiene la energía calorífica asociada a una reacción química, y cómo esta se utiliza para determinar variables de la misma. Sus aplicaciones en los campos de investigación justifican el alcance de estos métodos.
Esta capacidad se calcula dividiendo la cantidad de calor que absorbe el calorímetro entre la variación de la temperatura. Esta variación es producto del calor que se emite en una reacción exotérmica, la cual es igual a:
Cantidad de calor que absorbe el calorímetro + cantidad de calor que absorbe la disolución
Se puede determinar la variación añadiendo una cantidad de calor conocida midiendo el cambio de temperatura. Para esta determinación de la capacidad calórica el ácido benzoico suele usarse, ya que se conoce su calor de combustión (3,227 kJ/mol).
También se puede determinar la capacidad calórica mediante la adicción de calor mediante una corriente eléctrica.
Una barra de 95 g de un metal se calienta a 400 ºC, llevándose inmediatamente a un calorímetro con 500 g de agua, inicialmente a 20 ºC. La temperatura final del sistema es de 24 ºC. Calcule el calor específico del metal.
Δq = m x ce x Δt
En esta expresión:
Δq = variación de carga.
m = masa.
ce = calor específico.
Δt = variación de temperatura.
El calor ganado por el agua es igual al calor desprendido de la barra de metal.
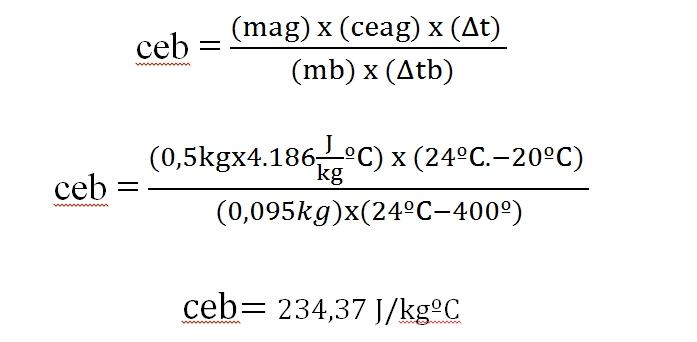
Este valor se parece al que aparece en una tabla del calor específico para la plata (234 J/kg ºC).
Entonces, una de las aplicaciones de la calorimetría es la cooperación para la identificación de materiales.
Consta de un recipiente de acero, conocido como la bomba, resistente a las altas presiones que pueden originarse durante las reacciones que ocurren en este envase; este envase va conectado a un circuito de ignición para comenzar las reacciones.
La bomba está inmersa en un envase grande con agua, cuya función es absorber el calor que se genera en la bomba durante las reacciones, haciendo que la variación de temperatura sea pequeña. El recipiente de agua está dotado de un termómetro y un agitador mecánico.
Los cambios energéticos se miden prácticamente a volumen y temperatura constantes, por lo que no se realiza trabajo en las reacciones que ocurren en la bomba.
ΔE = q
ΔE es la variación de la energía interna en la reacción y q el calor generado en esta.
El calorímetro presenta dos celdas: en una se coloca la muestra y en la otra, la de referencia, generalmente se coloca agua.
La diferencia de temperatura que se genera entre las celdas —debido a la reacción que ocurre en la celda de la muestra— es anulada mediante un sistema de retroalimentación que inyecta calor para igualar las temperaturas de las celdas.
Este tipo de calorímetro permite seguir la interacción entre las macromoléculas y sus ligandos.
Este calorímetro presenta dos celdas, igual que el CTI, pero tiene un dispositivo que permite determinar la temperatura y los flujos de calor asociados a los cambios de un material en función del tiempo.
Esta técnica da información acerca del plegamiento de las proteínas y los ácidos nucleicos, así como de su estabilización.
-La calorimetría permite determinar el intercambio de calor que ocurre en una reacción química, permitiendo así entender más claramente el mecanismo de esta.
-Mediante la determinación del calor específico de un material, la calorimetría aporta datos que ayudan a su identificación.
-Como hay una proporcionalidad directa entre el cambio de calor de una reacción y la concentración de los reactantes, aunado al hecho de que la calorimetría no requiere de muestras límpidas, se puede usar esta técnica para determinar la concentración de sustancias presentes en matrices complejas.
-En el campo de la ingeniería química se usa la calorimetría en el proceso de seguridad, así como en diferentes campos del proceso de optimización, reacción química y en la unidad de operación.
-Colabora en el establecimiento del mecanismo de acción enzimática, así como en su cinética. Esta técnica puede medir las reacciones entre moléculas, determinando la afinidad de enlace, la estequiometría, la entalpía y la entropía en solución sin la necesidad de marcadores.
-Evalúa la interacción de las nanopartículas con las proteínas y, en conjunto con otros métodos analíticos, es una herramienta importante para registrar los cambios conformacionales de las proteínas.
-Tiene aplicación en la conservación de los alimentos y en los cultivos.
-En cuanto a la conservación de los alimentos, puede determinar su deterioro y tiempo de vida en los estantes (actividad microbiológica). Puede comparar la eficiencia de diferentes métodos de conservación de los alimentos, y es capaz de determinar la dosis óptima de conservantes, así como la degradación en el control de empaquetamiento.
-En cuanto a cultivos de vegetales, puede estudiar la germinación de la semilla. Al estar en agua y en presencia de oxígeno, estas liberan calor que puede medirse con un calorímetro isotérmico. Examina la edad y almacenamiento inadecuado de las semillas y estudia su velocidad de crecimiento ante variaciones de temperatura, pH o de diferentes químicos.
-Finalmente, puede medir la actividad biológica de los suelos. Además, puede detectar enfermedades.
-Junto con la calorimetría isotérmica, ha permitido estudiar la interacción de proteínas con sus ligandos, la interacción alostérica, el plegamiento de las proteínas y el mecanismo de su estabilización.
-Se puede medir directamente el calor que se libera o absorbe durante un evento de enlace molecular.
-La calorimetría de escaneo diferencial es una herramienta termodinámica para el establecimiento directo de la captación de energía calórica que ocurre en una muestra. Esto permite analizar los factores que intervienen en la estabilidad de la molécula proteica.
-También estudia la termodinámica de la transición del plegamiento de los ácidos nucleicos. La técnica permite la determinación de la estabilidad oxidativa del ácido linoleico aislado y acoplado a otros lípidos.
-La técnica se aplica en la cuantificación de los nanosólidos de uso farmacéuticos y en la caracterización térmica de transportadores de lípidos nanoestructurados.
- Whitten, K., Davis, R., Peck, M. and Stanley, G. Chemistry. (2008). 8th ed. Cengage Learning Edit.
- Rehak, N. N. and Young, D. S. (1978). Prospective applications of calorimetry in the clinical laboratory. Clin. Chem. 24(8): 1414-1419.
- Stossel, F. (1997). Applications of reaction calorimetry in chemical engineering. J. Therm. Anal. 49(3): 1677-1688.
- Weber, P. C. and Salemme, F. R. (2003). Applications of calorimetric methods to drug discovery and the study of protein interactions. Curr. Opin. Struct. Biol. 13(1): 115-121.
- Gill, P., Moghadem, T. and Ranjbar, B. (2010). Differential scanning calorimetric techniques: applications in Biology and nanoscience. J. Biol. Tech.21(4):167-193.
- Omanovic-Miklicanin, E., Manfield, I. and Wilkins, T. (2017). Applications of isothermal titration calorimetry in evaluation of protein-nanoparticle interactions. J. Therm. Anal. 127:605-613.
- Community College Consortium for Bioscience Credentials. (07 de julio de 2014). Coffee cup calorimeter. [Figura]. Recuperado el 07 de junio de 2018, de: commons.wikimedia.org
