Sulfato de calcio (CaSO4): estructura química, propiedades, usos
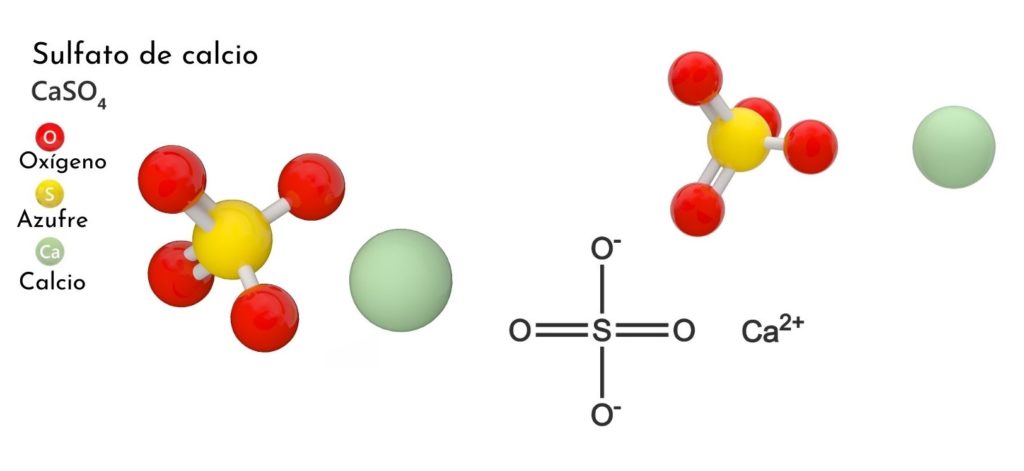
¿Qué es el sulfato de calcio?
El sulfato de calcio es una sal ternaria de calcio, metal alcalinotérreo (Sr. Becambara), azufre y oxígeno. Su fórmula química es CaSO4, lo que significa que por cada catión Ca2+ hay un anión SO42- interaccionando con este. Constituye un compuesto con amplia distribución en la naturaleza.
Sus formas más abundantes son el CaSO4·2H2O (el yeso) y la forma anhidra CaSO4 (la anhidrita). Existe también una tercera forma: el yeso o plaster de París, producido por el calentamiento del yeso (el hemidrato, CaSO4·1/2H2O).
El sulfato de calcio es un compuesto de gran utilidad en el quehacer del ser humano, ya que es utilizado en numerosas funciones que incluyen la construcción de carreteras, el embellecimiento del hogar e incluso la reparación de huesos.
Estructura química del sulfato de calcio
En la imagen superior se muestra la celda unitaria ortorrómbica para el CaSO4. Aquí se asume que las interacciones son puramente electrostáticas; es decir, que los cationes Ca2+ atraen los aniones tetraédricos SO42–.
Sin embargo, el Ca2+ es altamente propenso a coordinarse, formando estructuras poliédricas a su alrededor. ¿A qué se debe? A la disponibilidad electrónica del calcio de aceptar electrones de especies básicas o negativas (como los átomos de O del SO42–).
Considerando el punto anterior, ahora los iones Ca2+ aceptan enlaces dativos (aportados por los O) y la celda unitaria se transforma, tal como indica la imagen inferior:
Consecuentemente, se forma el poliedro CaO8 (la esfera verde de Ca2+ rodeada por ocho esferas rojas de O de los tetraedros SO4 cercanos). Poliedros de calcio y tetraedros de sulfatos; esta es la estructura cristalina del CaSO4 anhidro.
Adicionalmente, cuando los cristales se hidratan —formando la sal di-hidratada o el hemidrato (CaSO4·1/2 H2O)— la estructura se dilata para incorporar las moléculas de agua.
Estas moléculas pueden intercalarse y coordinarse con el calcio; es decir, reemplazan a uno o dos grupos sulfatos.
Por otro lado, no toda el agua pasa a integrar el poliedro CaO8. Algunas, en cambio, forman puentes de hidrógeno con los sulfatos. Estos sirven de unión para dos tramos en zigzag, productos de la disposición de los iones en el cristal.
Propiedades del sulfato de calcio

Fórmula molecular
CaSO4·nH2O.
Peso molecular anhidro
136,134 g/mol.
Olor
Es inodoro.
Aspecto
En el caso de la anhidrita, luce como un polvo blanco o cristales sólidos ortorrómbicos o monoclínicos. Los cristales son de un color variable: pueden ser blancos o con un tinte azulado, grisáceo, o rojizo; también puede ser de color rojo ladrillo.
Densidad
2,96 gr/cm3 (forma anhidra). 2,32 gr/cm3 (forma dihidratada).
Punto de fusión
1450 ºC (2840 ºF). Característico de las fuertes interacciones electrostáticas entre los iones divalentes Ca2+ y SO42-.
Solubilidad
0,2-0,3 % en agua a 25 ºC. Es poco soluble en agua e insoluble en etanol.
Estabilidad
Estable a temperatura ambiente.
Usos del sulfato de calcio
En la construcción y en el arte
Se usa en la elaboración del estuco para frisar las paredes de los hogares y otras construcciones que contribuyen a su embellecimiento. Además, se realizan relieves mediantes moldes en los techos y marcos de las ventanas. El yeso también está en los cielos rasos.
Se usa el sulfato de calcio para ayudar a resolver el problema que se presenta en la hidratación del concreto, colaborando así en la construcción de carreteras, avenidas, etc.
Con el yeso se elaboran esculturas, sobre todo figuras religiosas, y en los cementerios se usan en las lápidas.
Terapéuticos
Veterinaria
Experimentalmente, en veterinaria se han usado piezas de sulfato de calcio estériles para reparar defectos óseos o cavidades, tales como aquellas dejadas por heridas o tumores.
El plaster o yeso de París puede ser usado para reparar defectos de los huesos por su capacidad única de estimular la osteogénesis. Estudios de rayos x y tecnecio (Tc99m) medronato dan soporte al uso del yeso de París como aloplástico y a su capacidad osteogénica cuando es implantado en el seno frontal.
Una regeneración ósea ha sido demostrada en seis perros en un período de 4 a 6 meses. El sulfato de calcio comenzó a usarse en este campo en 1957, bajo la forma de tabletas de yeso de París, lográndose rellenar defectos en los huesos de perros.
La sustitución ósea del sulfato de calcio es comparable a la observada en el hueso autogénico.
Ruhaimi (2001) aplicó el sulfato de calcio en un hueso de mandíbula de conejo recién destruida, observando un incremento de la osteogénesis y la calcificación ósea.
Medicina
El sulfato de calcio es usado en medicina para inmovilizar las articulaciones que han sufrido luxaciones y en los huesos fracturados, además de utilizarse como excipiente en la elaboración de tabletas.
Odontología
En odontología se usa como base para elaborar las prótesis dentales, en restauraciones e impresiones de los dientes.
En la elaboración de los alimentos
Es usado como coagulante en la elaboración del tofu, un alimento hecho con soya y de gran consumo en los países orientales como sustituto de la carne. Además, se ha usado como reafirmante de alimentos y en el tratamiento de las harinas.
Como fertilizante y acondicionador de los suelos de cultivos
El yeso (CaSO4·2H2O) fue utilizado como fertilizante en Europa desde el siglo XVIII, teniendo la ventaja sobre el uso de la cal como fuente de calcio de una mayor movilidad.
El calcio debe estar disponible para las raíces de las plantas para su adecuado abastecimiento. Entonces, la adición de calcio mejora los cultivos hortícolas y del cacahuete (maní).
La pudrición de las raíces del cacahuete producida por agentes patógenos biológicos, así como la podredumbre apical de la sandía y el tomate, son parcialmente controladas con las aplicaciones del yeso agrícola.
El yeso ayuda a reducir la dispersión de la arcilla, causante de la formación de costras sobre el suelo. Al reducir las costras formadas sobre el suelo, el yeso facilita la salida de las plántulas. Asimismo, aumenta la entrada de aire y agua al suelo.
El yeso ayuda al mejoramiento del suelo al mitigar la acidez y toxicidad del aluminio, adecuando así el cultivo para los suelos sódicos.
En la producción de otros compuestos
El sulfato de calcio reacciona con el bicarbonato de amonio para formar sulfato de amonio. También se ha utilizado en el proceso de producción del ácido sulfúrico.
Se mezcla sulfato de calcio anhidro con esquisto o magra y, al ser calentada la mezcla, se libera trióxido de azufre en forma gaseosa. El óxido de azufre es un precursor del ácido sulfúrico.
