Entalpía de reacción: definición, termoquímica, ejercicios
La entalpía de reacción es una función termodinámica que permite calcular el calor ganado o entregado en una reacción química, siempre que esta reacción haya ocurrido a presión constante. Se define como la energía interna U más el producto de la presión P por el volumen V de la sustancias que intervienen en una reacción química, de la siguiente forma: H = U + P∙V
Por lo tanto la entalpía tiene dimensiones de energía, y en el Sistema Internacional de medidas se mide en Joules. Para entender la relación de la entalpía con el calor intercambiado en una reacción química es necesario recordar la primera ley de la termodinámica, que establece lo siguiente: Q= ΔU + W

La primera ley establece que el calor intercambiado en un proceso termodinámico es igual a la variación de la energía interna de la sustancias que intervienen en el proceso más el trabajo realizado por dichas sustancias en el proceso.
En un proceso cualquiera el trabajo W se calcula mediante la siguiente relación:

En la expresión anterior Vi es el volumen inicial, Vf el volumen final y P la presión. Si el proceso se lleva a cabo a presión constante P, entonces el trabajo resultante será:

Donde ΔV es la variación de volumen.
Índice del artículo
- 1 Definición
- 2 Relación con el calor
- 3 Entalpía estándar
- 4 Termoquímica
- 5 Ejercicios resueltos
- 6 Referencias
Las reacciones químicas son procesos termodinámicos que generalmente ocurren a presión constante y muy frecuentemente a presión atmosférica. Este tipo de procesos termodinámicos se denomina “isobárico”, ya que ocurre a presión constante.
En este caso la primera ley de la termodinámica puede escribirse así:
Qp=ΔU + P∙ΔV
Donde Qp indica que el calor se ha intercambiado a presión constante. Si en la expresión anterior se introduce la definición de entalpía H = U + P∙V obtenemos entonces:
Qp = ΔH
De allí se tiene que un cambio de entalpía positivo indica una reacción que ha tomado calor del ambiente. Esto es una reacción endotérmica.
Por el contrario, si el cambio de entalpía es negativo se trata entonces de una reacción exotérmica.
De hecho, la palabra entalpía proviene de la palabra griega enthalpien, cuyo significado es “calentar”.
Frecuentemente a la entalpía se la llama también calor. Pero debe estar claro que no es lo mismo que calor, sino que es el intercambio de calor durante el proceso termodinámico el que cambia la entalpía.
A diferencia del calor, la entalpía es una función de estado. Cuando se calcula el cambio de entalpía, se está calculando la diferencia de dos funciones que dependen exclusivamente del estado del sistema como lo son la energía interna y el volumen.
ΔH=ΔU + P∙ΔV
Como en la reacción la presión permanece constante, entonces la entalpía de reacción es una función de estado que solo depende de la energía interna y del volumen.
En una reacción química se puede definir la entalpía de los reactivos como la suma de la de cada uno de ellos; y la de los productos como la suma de la entalpía de todos los productos.
El cambio de entalpía en una reacción es la diferencia de la de los productos menos la de los reactivos:

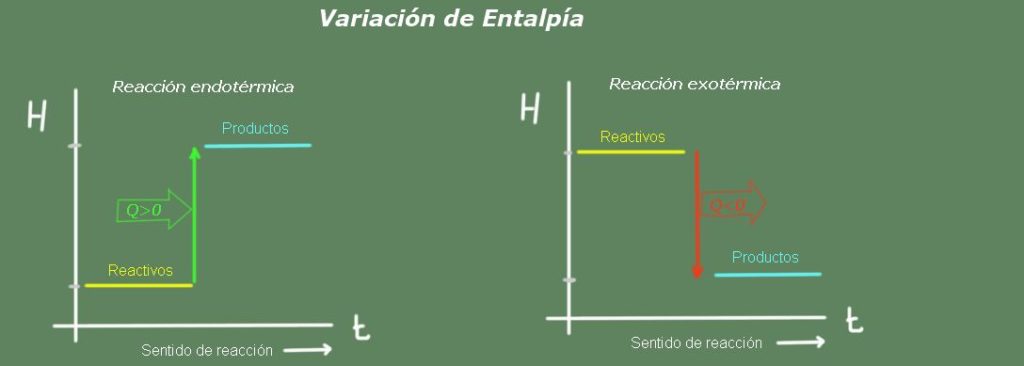
En una reacción endotérmica la entalpía de los productos es mayor que la de los reactivos; es decir, la reacción toma calor del ambiente. Por el contrario, en una reacción exotérmica la entalpía de los reactivos es mayor que la de los productos, ya que la reacción cede calor al ambiente.
Como el cambio de entalpía en una reacción química puede depender de la presión y la temperatura, es costumbre definir las condiciones estándar de reacción:
Temperatura estándar de reacción: 25 °C.
Presión estándar de reacción: 1 atm = 1 bar.
La entalpía estándar se denota así: H°
En una ecuación termoquímica no solo importan los reactivos y los productos, también importa la variación de entalpía. Se entiende por entalpía de la reacción al cambio de ella que tuvo a lugar durante la misma.
Como ejemplo veamos las siguientes reacciones:
2 H2 (gas) + O2 (gas) → 2 H2O (líquido) ; ΔH° = -571,6 kJ (exotérmica).
H2 (gas) + (½) O2 (gas) → H2O (líquido) ; ΔH° = -285,8 kJ (exotérmica).
2 H2O (líquido) →2 H2 (gas) + O2 (gas) ; ΔH° = +571,6 kJ (endotérmica).
Si se multiplican o dividen los términos de una ecuación química por un cierto factor, entonces la entalpía queda multiplicada o dividida por el mismo.
Si se invierte la reacción, entonces también se invierte el signo de la entalpía de reacción.
El gas acetileno C2H2 se obtiene de la reacción del carburo cálcico CaC2 que viene en forma granulada con agua a temperatura y presión ambiental.
Como dato se tienen las entalpías de formación de los reactivos:
ΔH°( CaC2 )= -59,0 kJ/mol
ΔH°( H20 )= -285,8 kJ/mol
Y la entalpía de formación de los productos:
ΔH°( C2H2 )= +227,0 kJ/mol
ΔH°( Ca(OH)2 )= -986,0 kJ/mol
Encuentre la entropía estándar de la reacción.
Solución
Lo primero es plantear la ecuación química balanceada:
CaC2 (s) + 2H20 (l) → Ca(OH)2 (s) + C2H2 (g)
Y ahora las entalpías de los reactivos, productos y de la reacción:
– Reactivos: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
– Productos: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
– Reacción: ΔH° = -759 kJ/mol – (-630 kJ/mol) = -129 kJ/mol
Se trata de una reacción exotérmica.
Cuando se quema 1 litro de acetileno en condiciones estándar, ¿cuánto calor se desprende?
Solución
La reacción de combustión del acetileno una vez balanceada queda así:
C2H2 (g) + (5/2) O2 (g)→ 2 CO2 (g) + H20 (l)
Necesitamos las entalpías de formación de los productos:
ΔH° (CO2) = -393,5 kJ/mol
ΔH° (H2O (l)) = -285,8 kJ/mol
Cálculo de las entalpías
Con estos datos podemos calcular la entalpía de los productos:
ΔH° (productos) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
Y la entalpía de formación de los reactivos:
ΔH° (C2H2) = 227,0 kJ/mol
ΔH° (O2) = 0,0 kJ/mol
La entalpía de los reactivos será:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
La entalpía de reacción molar será entonces: ΔH°(productos) – ΔH°(reactivos)= -1072,8kJ/mol – 227,0 kJ/mol = -1299,8 kJ/mol
Entalpía de combustión
Ahora necesitamos saber cuántos moles de acetileno son un litro de acetileno en condiciones estándar. Para esto usaremos la ecuación de estado de un gas ideal, de la que despejaremos el número de moles.
Número de moles n = P*V/( R*T)
P= 1 atm= 1,013 x 10⁵ Pa
V= 1 l= 1,0 x 10^-3 m³
R= 8,31 J/(mol*K)
T= 25°C= 298,15 K
n= 0,041 mol
La entalpía de la combustión de 1 litro de acetileno es 0,041 mol * (-1299,8 kJ/mol) = -53,13 kJ
El signo negativo indica que es una reacción exotérmica que desprende 53,13 kJ= 12,69 kcal.
- Castaños E. La entalpía en las reacciones químicas. Recuperado de: lidiaconlaquimica.wordpress.com
- Termoquímica. Entalpía de reacción. Recuperado de: recursostic.educacion.es
- Termoquímica. Definición de entalpía de reacción estándar. Recuperado de: quimitube.com
- Wikipedia. Entalpía estándar de reacción. Recuperado de: wikipedia.com
- Wikipedia. Entalpía de formación. Recuperado de: wikipedia.com
