Bromuro de litio: estructura, propiedades, usos, riesgos
El bromuro de litio es una sal neutra de un metal alcalino cuya fórmula química es LiBr. La fórmula expresa que su sólido cristalino se compone de iones Li+ y Br– en una relación 1:1. Sus cristales son de color blanco o beige claro. Es muy soluble en el agua y además, es una sal bastante higroscópica.
Esta última propiedad permite su uso como desecante en los sistemas de aire acondicionado y refrigeración. Asimismo, el bromuro de litio fue empleado desde el comienzo del siglo XX en el tratamiento de ciertos trastornos de la salud mental, abandonándose su utilización debido a un uso inadecuado de la sal.
El LiBr se produce mediante el tratamiento del carbonato de litio, Li2CO3, con ácido bromhídrico. Tras calentamiento del medio, precipita en la solución acuosa como un hidrato.
Esta sal irrita por contacto la piel y los ojos, mientras produce por inhalación la irritación de los conductos respiratorios. La ingesta de las sales de litio puede producir náuseas, vómitos, diarrea y mareo.
Índice del artículo
- 1 Estructura del bromuro de litio
- 2 Propiedades
- 2.1 Peso molecular
- 2.2 Apariencia
- 2.3 Olor
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Solubilidad en agua
- 2.7 Solubilidad en solventes orgánicos
- 2.8 Índice de refracción (ηD)
- 2.9 Capacidad calórica
- 2.10 Entropía molar estándar (Sθ 298)
- 2.11 Punto de ignición
- 2.12 Estabilidad
- 2.13 Descomposición
- 2.14 pH
- 2.15 Reactividad
- 2.16 Producción
- 3 Nomenclatura
- 4 Usos
- 5 Riesgos
- 6 Referencias
La fórmula LiBr deja claro que la proporción Li/Br es igual a 1; por cada catión Li+ debe haber un anión Br– de contraparte. Por lo tanto, dicha proporción debe mantenerse constante en todos los rincones del cristal de LiBr.
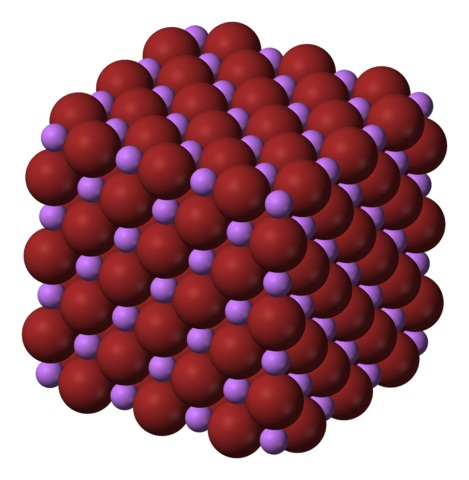
Los iones Li+ y Br– se atraen mutuamente, disminuyendo las repulsiones entre cargas iguales, para de esta manera originar un cristal cúbico tipo sal de gema; este es isomórfico al NaCl (imagen superior). Nótese que de por sí todo el conjunto tiene una geometría cúbica.
En este cristal, los Li+ son más pequeños y tienen un color violeta claro; mientras que los Br– son más voluminosos y de un color marrón intenso. Se observa que cada ion tiene seis vecinos, lo cual es igual a decir que presentan una coordinación octaédrica: LiBr6 o Li6Br; sin embargo, si se considera la celda unitaria, la proporción Li/Br sigue siendo 1.
Esta es la estructura cristalina adoptada preferiblemente por el LiBr. No obstante, también puede formar otros tipos de cristales: wurzita, si cristaliza a bajas temperaturas (-50°C) sobre un sustrato; o cúbica centrada en el cuerpo, o tipo CsCl, si el cristal cúbico sal de gema se somete bajo una alta presión.
Lo anterior dicho es aplicable para el LiBr anhidro. Esta sal es higroscópica, y puede por tanto absorber humedad del medio, intercalando moléculas de agua dentro de sus propios cristales. Así, surgen los hidratos LiBr·nH2O (n = 1, 2, 3…, 10). Para cada hidrato, la estructura cristalina es diferente.
Por ejemplo, estudios cristalográficos determinaron que el LiBr·H2O adopta una estructura tipo perovskita.
Cuando estos hidratos están en solución acuosa, pueden sobreenfriarse y vitrificarse; esto es, adoptan una estructura en apariencia cristalina, pero molecularmente desordenada. En tales condiciones, los puentes de hidrógeno del agua cobran bastante importancia.
88,845 g/mol.
Sólido cristalino blanco o beige claro.
Inodoro.
552 ºC (1.026 ºF, 825 K).
1.256 ºC (2.309 ºF, 1.538 K).
166,7 g/100 mL a 20 ºC. Nótese su alta solubilidad.
Soluble en metanol, etanol, éter y acetona. Ligeramente soluble en piridina, compuesto aromático y menos polar que los anteriores.
1,784.
51,88 J/mol·K.
66,9 J/mol·K.
1.265 ºC. Se considera no inflamable.
Estable. La forma anhidra, sin embargo, es extremadamente higroscópica.
Cuando se descompone por calentamiento, origina óxido de litio.
Entre pH 6 y 7 en solución acuosa (100 g/L, 20 ºC).
El bromuro de litio no es reactivo bajo las condiciones ambientales normales. Sin embargo, puede experimentar reacciones intensas con ácidos fuertes al incrementarse la temperatura.
Al disolverse en agua, se produce un incremento de la temperatura, causado por una entalpía negativa de hidratación.
Se produce LiBr haciendo reaccionar el hidróxido de litio o el carbonato de litio con el ácido bromhídrico en una reacción de neutralización:
Li2CO3 + HBr => LiBr + CO2 + H2O
El bromuro de litio es obtenido como un hidrato. Para obtener la forma anhidra, es necesario el calentamiento de la sal hidratada bajo vacío.
El nombre ‘bromuro de litio’ deriva del hecho de ser un halogenuro metálico, llamado así de acuerdo a la nomenclatura stock. Otros nombres, igual de válidos pero menos usados, son el monobromuro de litio, de acuerdo a la nomenclatura sistemática; y el bromuro lítico (la valencia única de +1 para el litio), de acuerdo a la nomenclatura tradicional.
El LiBr es una sal higroscópica, formando una salmuera concentrada capaz de absorber la humedad del aire en una gama amplia de temperaturas. Esta salmuera es usada como desecante en los sistemas de aire acondicionado y refrigeración.
Se utiliza para aumentar el volumen de la lana, del pelo y de otras fibras orgánicas.
El LiBr forma aductos con algunos compuestos farmacéuticos, modulando su acción. Un aducto es la combinación mediante coordinación de dos o más moléculas, sin que se produzca una alteración estructural de ninguna de las moléculas unidas.
El bromuro de litio se usó al principio como un sedante en ciertos trastornos mentales, dejándose de usar en 1940. Actualmente, se usa el carbonato de litio; pero en todo caso, el litio es el elemento que ejerce la acción terapéutica en ambos compuestos.
El litio es usado en el tratamiento del trastorno bipolar, habiendo sido útil en el control de los episodios maníacos del trastorno. Se piensa que el litio inhibe la actividad de los neurotransmisores excitatorios, como la dopamina y el ácido glutámico.
Por otro lado, aumenta la actividad del sistema inhibitorio mediado por el neurotransmisor ácido gamma-amino-butírico (GABA). Estas acciones podrían formar parte de la base de la acción terapéutica del litio.
Irritación y sensibilización cutáneas, alergias. Lesiones oculares graves o irritación ocular, en las vías respiratorias, fosas nasales y garganta.
Los síntomas principales por ingesta de bromuro de litio son: trastornos gastrointestinales, vómitos y náuseas. Otros efectos adversos de la ingestión de la sal incluyen agitación, espasmos y pérdida de la conciencia.
La condición conocida como “bromismo” puede producirse con dosis de bromuro de litio superiores a 225 mg/día.
En el bromismo pueden presentarse algunos de los síntomas y signos siguientes: exacerbación del acné y pérdida del apetito, temblores, problemas del habla, apatía, debilidad y agitación maniática.
- Formulación Química. (2019). Bromuro de litio. Recuperado de: formulacionquimica.com
- David C. Johnson. (10 de julio de 2008). New order for lithium bromide. Nature. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Structural Phase Transition in Lithium Bromide: Effect of Pressure and Temperature. [PDF]. Recuperado de: ncpcm.in
- Takamuku y col. (1997). X-ray Diffraction Studies on Supercooled Aqueous Lithium Bromide and Lithium Iodide Solutions. Department of Chemistry, Faculty of Science, Fukuoka University, Nanakuma, Jonan-ku, Fukuoka 814-80, Japan.
- National Center for Biotechnology Information. (2019). Lithium bromide. PubChem Database, CID=82050. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Lithium bromide. Recuperado de: en.wikipedia.org
- Royal Society of Chemistry. (2019). Lithium bromide. Chemspider. Recuperado de: chemspider.com
