Carga formal: concepto, fórmula, cómo calcularla, ejemplos
¿Qué es la carga formal?
La carga formal (CF) es aquella que se asigna a un átomo de una molécula o ion, la cual permite explicar sus estructuras y propiedades químicas en función de esta. Este concepto implica la consideración del máximo carácter de covalencia en el enlace A-B; esto es, el par de electrones se comparte equitativamente entre A y B.
Para comprender lo anterior en la imagen inferior se muestran dos átomos enlazados: uno designado con la letra A y el otro con la letra B. Como se puede apreciar, en el intercepto de los círculos se forma un enlace con el par “:”. En esta molécula heteronuclear, si A y B tienen iguales electronegatividades el par “:” permanece equidistante tanto a A como a B.
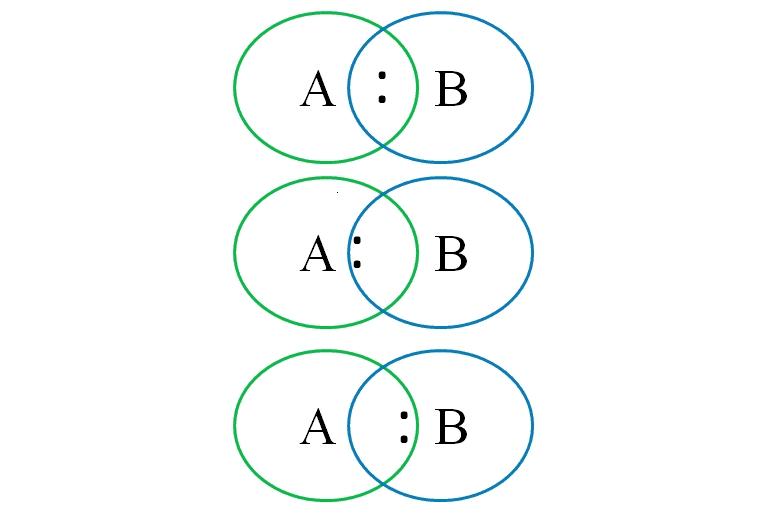
Sin embargo, dado que dos átomos diferentes no pueden tener propiedades idénticas, el par “:” es atraído por el que es más electronegativo. En este caso, si A es más electronegativo que B, el par “:” se encuentra más cerca de A que de B. Lo contrario ocurre cuando B es más electronegativo que A, acercándose ahora “:” a B.
Entonces, para asignar las cargas formales tanto a A como a B, es necesario considerar el primer caso (el de arriba de la imagen). Si el enlace puramente covalente A-B se rompiera, ocurriría una ruptura homolítica, generando los radicales libres A· y ·B.
Beneficios cualitativos del empleo de la carga formal
Los electrones no se encuentran fijos, como en el ejemplo anterior, sino que viajan y se pierden por los átomos de la molécula o ion. Si es una molécula diatómica se sabe que el par “:” debe estar compartido o vagando entre ambos átomos; lo mismo ocurre en una molécula del tipo A-B-C, pero con mayor complejidad.
Sin embargo, al estudiarse un átomo y asumir una covalencia del cien por ciento en sus enlaces, es más fácil establecer si este dentro del compuesto gana o pierde electrones. Para determinar esta ganancia o pérdida, debe compararse su estado basal o libre frente a su entorno electrónico.
De este modo, es posible asignar una carga positiva (+) si el átomo pierde un electrón, o una carga negativa (-) cuando, al contrario, gana un electrón (los signos deben escribirse dentro de un círculo).
Así, aunque los electrones no puedan ubicarse con exactitud, estas cargas formales (+) y (-) en las estructuras se ajustan en la mayoría de los casos a las propiedades químicas esperadas.
Es decir, la carga formal de un átomo está estrechamente relacionada con la geometría molecular de su entorno y su reactividad dentro del compuesto.
Fórmula y cómo calcularla
¿Las cargas formales se asignan arbitrariamente? La respuesta es no. Para ello debe calcularse la ganancia o pérdida de electrones asumiendo enlaces puramente covalentes, y esto se logra a través de la siguiente fórmula:
CF= (número de grupo del átomo) – (número de enlaces que forma) – (número de electrones no compartidos)
Si el átomo tiene una CF con un valor de +1, se le asigna una carga positiva (+); mientras que si tiene una CF con un valor de -1, se le asigna entonces una carga negativa (-).
Para calcular correctamente la CF, deben seguirse los pasos a continuación:
- Ubicar en cuál grupo se encuentra el átomo dentro de la tabla periódica.
- Contar el número de enlaces que forma con sus vecinos: los dobles enlaces (=) valen por dos y los triples enlaces valen por tres (≡).
- Por último, contar el número de electrones no compartidos, los cuales pueden observarse fácilmente con las estructuras de Lewis.
Variaciones del cálculo de acuerdo con la estructura
Dada la molécula lineal A-B-C-D, las cargas formales para cada átomo pueden variar si la estructura, por ejemplo, se escribe ahora como: B-C-A-D, C-A-B-D, A-C-D-B, etc. Esto es debido a que hay átomos que, al compartir más electrones (formar más enlaces), adquieren CF positivas o negativas.
Entonces, ¿cuál de las tres estructuras moleculares posibles corresponde al compuesto ABCD? La respuesta es: aquella que generalmente posea los menores valores de CF; asimismo, aquella que asigne las cargas negativas (-) a los átomos más electronegativos.
Si C y D son más electronegativos que A y B, entonces al compartir más electrones adquieren por consecuencia cargas formales positivas (visto desde una regla nemotécnica).
Siendo así, la estructura más estable, y la más favorecida energéticamente, es C-A-B-D, ya que en esta tanto C como B forman solo un enlace. En cambio, la estructura A-B-C-D y aquellas que tengan a C o B formando dos enlaces (–C– o –D–), son más inestables.
¿Cuál de todas las estructuras es la más inestable? A-C-D-B, debido a que no solo C y D forman dos enlaces, sino que además sus cargas formales negativas (-) están adyacentes una de otra, desestabilizando aún más la estructura.
Ejemplos de cálculos de cargas formales
BF4– (ion tetrafluoroborato)
El átomo de boro se encuentra rodeado de cuatro átomos de flúor. Dado que el B pertenece al grupo IIIA (13) carece de electrones no compartidos y forma cuatro enlaces covalentes, se tiene que su CF es (3-4-0= -1). En cambio para el F, elemento del grupo VIIA (17), su CF es (7-6-1= 0).
Para determinar la carga del ion o molécula basta con sumar las CF individuales de los átomos que la componen: (1(-1) + 4(0)= -1).
Sin embargo, la CF para el B no tiene un significado real; esto es, sobre este no reside la mayor densidad electrónica. En realidad, esta densidad electrónica se distribuye hacia los cuatro átomos de F, elemento mucho más electronegativo que el B.
BeH2 (hidruro de berilio)
El átomo de berilio pertenece al grupo IIA (2), forma dos enlaces y carece, nuevamente, de electrones no compartidos. Así, las CF para el Be y el H son:
CFBe= 2-2-0= 0
CFH= 1-1-0= 0
Carga BeH2= 1(0) + 2(0)= 0
CO (monóxido de carbono)
Su estructura de Lewis puede representarse como :C≡O: (aunque presenta otras estructuras de resonancia). Repitiendo el cálculo de la CF, esta vez para el C (del grupo IVA) y el O (del grupo VIA), se tiene:
CFC= 4-3-2= -1
CFO= 6-3-2= +1
Este es un ejemplo donde las cargas formales no se ajustan a la naturaleza de los elementos. El O es más electronegativo que el C y, por tanto, no debería portar una positiva.
Las otras estructuras (C=O y (+)C-O(–)), si bien cumplen con el asignamiento coherente de las cargas, incumplen con la regla del octeto (el C tiene menos de ocho electrones de valencia).
NH4+ (ion amonio), NH3 y NH2– (ion amiduro)
Mientras más electrones comparte el N, más positivo es su CF (hasta el ion amonio, ya que no tiene disponibilidad energética para formar cinco enlaces).
Aplicando igualmente los cálculos para el N en el ion amonio, el amoníaco y el ion amiduro, se tiene entonces:
CF= 5-4-0= +1 (NH4+)
CF= 5-3-2= 0 (NH3)
Y finalmente:
CF= 5-2-4= -1 (NH2–)
Es decir, en el NH2– el N tiene cuatro electrones no compartidos, y comparte todos cuando forma el NH4+. Las CF para los H es igual a 0 y, por lo tanto, se ahorra su cálculo.
