Proteínas G: estructura, tipos y funciones
Las proteínas G o proteínas de unión a nucleótidos de guanina, son proteínas asociadas con la membrana plasmática pertenecientes a una familia de proteínas “acopladoras” de señales que tienen importantes funciones en muchos procesos de transducción de señales en los organismos eucariotas.
En la literatura, las proteínas G son descritas como interruptores moleculares binarios, puesto que su actividad biológica está determinada por los cambios en su estructura dados por la especie nucleotídica a la que son capaces de unirse: los nucleótidos de guanosina (difosfato (GDP) y trifosfato (GTP)).
Generalmente son activadas por receptores de una familia de proteínas conocida como Receptores Acoplados a Proteínas G (GPCR, del inglés “G-protein-coupled receptors”), quienes reciben una señal inicial externa y la convierten en cambios conformacionales que disparan la activación, que se traduce posteriormente en la activación de otra proteína efectora.
Algunos autores consideran que los genes codificantes para esta familia de proteínas evolucionaron por duplicación y divergencia de un gen común ancestral, cuyo producto se fue refinando y especializándose cada vez más.
Entre la gran variedad de funciones celulares que tienen estas proteínas están la translocación de macromoléculas durante la síntesis proteica, la transducción de señales hormonales y estímulos sensoriales, así como la regulación de la proliferación y diferenciación celular.
De este tipo de proteínas se han descrito dos clases: las proteínas G pequeñas y las proteínas G heterotriméricas. La primera estructura tridimensional de una proteína G se obtuvo hace más de una década a partir de una proteína G pequeña conocida como Ras.
Índice del artículo
Estructuralmente hablando, se reconocen dos tipos de proteínas G: las proteínas G pequeñas y las proteínas G heterotriméricas, mucho más complejas.
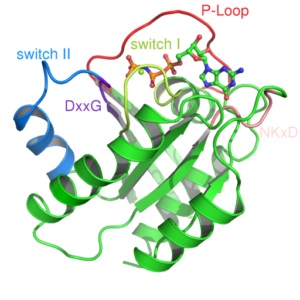
Las proteínas G pequeñas están formadas por un solo polipéptido de alrededor de 200 residuos aminoacídicos y unos 20-40 kDa, y en su estructura se halla un dominio catalítico conservado (el dominio G) compuesto por cinco hélices α, seis láminas β-plegadas y cinco bucles polipeptídicos.
Las proteínas G heterotriméricas, por otra parte, son proteínas integrales de membrana que están compuestas por tres cadenas polipeptídicas, conocidas como las subunidades α, β y γ.
-La subunidad α pesa entre 40 y 52 kDa, tiene una región de unión a nucleótidos de guanina y tiene actividad GTPasa para hidrolizar enlaces entre los grupos fosfato del GTP.
Las subunidades α de diferentes proteínas G comparten algunos dominios estructurales como los de unión e hidrólisis de GTP, pero son muy diferentes en los sitios de unión al receptor y a las proteínas efectoras.
-La subunidad β tiene un peso molecular ligeramente inferior (entre 35 y 36 kDa).
-La subunidad γ, por otra parte, es mucho más pequeña y tiene un peso molecular aproximado de 8 kDa.
Todas las proteínas G heterotriméricas tienen 7 dominios transmembranales y comparten similitud en su secuencia respecto a los dominios β e γ. Estos dos dominios están tan fuertemente asociados que son contemplados como una sola unidad funcional.
Como se mencionó anteriormente existen dos tipos de proteínas G: las pequeñas y las heterotriméricas.
Las proteínas G pequeñas tienen funciones en el crecimiento celular, la secreción de proteínas y la interacción de vesículas intracelulares. Por su parte, las proteínas G heterotriméricas están asociadas con la transducción de señales a partir de receptores de superficie, y también actúan como interruptores que alternan entre dos estados dependiendo del nucleótido asociado.
Estas proteínas también son llamadas pequeñas GTPasas, pequeñas proteínas de unión al GTP o superfamilia de proteínas Ras y forman una superfamilia independiente dentro de la gran clase de GTP hidrolasas con funciones reguladoras.
Estas proteínas son muy diversas y controlan múltiples procesos celulares. Se caracterizan por un dominio conservado de unión a GTP, el dominio “G”. La unión de este nucleótido fosfato provoca en las proteínas G pequeñas importantes cambios conformacionales en su dominio catalítico.
Su actividad está íntimamente relacionada con proteínas activadoras de GTPasas (GAP, del inglés “GTPase Activating Protein”) y con factores de intercambio de nucleótidos de guanina (GEF, del inglés “Guanine Nucleotide Exchange Factor”).
En los eucariotas se han descrito cinco clases o familias de proteínas G pequeñas:
-Ras
-Rho
-Rab
-Sar1/Arf
-Ran
Las proteínas Ras y Rho controlan la expresión genética y las proteínas Rho modulan también la reorganización del citoesqueleto. Las proteínas del grupo Rab y Sar1/Arf tienen influencia sobre el transporte vesicular y las proteínas Ran regulan el transporte nuclear y el ciclo celular.
Este tipo de proteínas también amerita una asociación con otros dos factores proteicos, de forma que la ruta de señalización desde el medio exterior hasta el interior celular se compone de tres elementos en el siguiente orden:
- Los receptores acoplados a proteínas G
- Las proteínas G
- Las proteínas o los canales efectores
Existe una gran diversidad de proteínas G heterotriméricas y ello se relaciona con la gran diversidad de subunidades α que existen en la naturaleza, en las que solo el 20% de la secuencia aminoacídica está conservada.
Usualmente las proteínas G heterotriméricas son identificadas gracias a la diversidad de la subunidad α, basado principalmente en sus similitudes funcionales y de secuencia.
Las subunidades α conforman de cuatro familias (la familia Gs, la familia Gi/o, la familia Gq y la familia G12). Cada familia está compuesta de un “isotipo” distinto que, en conjunto, suma más de 15 formas diferentes de subunidades α.
Familia Gs
Esta familia contiene representantes que también participan en la regulación positiva de las proteínas adenilato ciclasas y se expresa en la mayor parte de los tipos celulares. Está compuesta por dos miembros: Gs y Golf.
El subíndice “s” se refiere a estimulación (del inglés “stimulation”) y el subíndice “olf” se refiere a “olfato” (del inglés “olfaction”). Las proteínas Golf se expresan especialmente en las neuronas sensoriales responsables del olfato.
Familia Gi/o
Esta es la familia más grande y diversa. Se expresan en muchos tipos celulares y median la inhibición receptor-dependiente de varios tipos de adenilciclasas (el subíndice “i” se refiere a inhibición).
Las proteínas con las subunidades α del grupo Go se expresan especialmente en las células del sistema nervioso central y tienen dos variantes: A y B.
Familia Gq
Las proteínas con esta familia de subunidad α se encargan de la regulación de la fosfolipasa C. Esta familia consiste en cuatro miembros cuyas subunidades α son expresadas por genes diferentes. Son abundantes en las células hepáticas, en las células renales y en los pulmones.
Familia G12
Esta familia se expresa ubicuamente en los organismos y no se sabe con certeza cuáles son exactamente los procesos celulares regulados a través de las proteínas con estas subunidades.
Subunidades β y γ
A pesar de que la diversidad de las estructuras alfa es determinante para la identificación de las proteínas heterotriméricas, también hay mucha diversidad respecto a las otras dos subunidades: beta y gamma.
Las proteínas G participan en la “canalización” de las señales desde los receptores en la membrana plasmática hacia los canales o enzimas efectoras.
El ejemplo más común de la función de este tipo de proteínas es en la regulación de la enzima adenilato ciclasa, enzima responsable de la síntesis de adenosina 3’,5’-monofosfato o simplemente AMP cíclico, una molécula que tiene importantes funciones como segundo mensajero en muchos procesos celulares conocidos:
-Fosforilación selectiva de proteínas con funciones específicas
-Transcripción genética
-Reorganización del citoesqueleto
-Secreción
-Despolarización de la membrana
También participan indirectamente en la regulación de la cascada de señalización de los inositoles (fosfatidilinositol y sus derivados fosforilados), que se encargan del control de los procesos calcio-dependientes como la quimiotaxis y la secreción de factores solubles.
Muchos canales iónicos y proteínas de transporte están directamente controlados por proteínas de la familia de proteínas G. Del mismo modo, estas proteínas están implicadas en muchos procesos sensoriales como la visión, el olfato, entre otras.
El modo de interacción de una proteína G con las proteínas efectoras es propio de cada clase o familia de proteínas.
Para las proteínas G acopladas con receptores membranales (proteínas G heterotriméricas), la unión de un nucleótido de guanina como el GDP o guanosín difosfato a la subunidad α provoca la asociación de las tres subunidades, formando un complejo conocido como Gαβγ o G-GDP, que está unido a la membrana.
Si posteriormente la molécula de GDP es intercambiada por una molécula de GTP, la subunidad α unida al GTP se disocia de las subunidades β e γ, formando un complejo aparte conocido como Gα-GTP, que es capaz de alterar la actividad de sus enzimas o proteínas transportadoras diana.
La actividad hidrolítica de esta subunidad le permite terminar la activación, intercambiando el GTP por un nuevo GDP, pasando a la conformación inactiva.
En ausencia de los receptores excitados que se asocian con las proteínas G, este proceso de intercambio de GDP a GTP es muy lento, lo que quiere decir que las proteínas G heterotriméricas solo intercambian GDP por GTP a una velocidad fisiológicamente importante cuando están unidas a sus receptores excitados.
- Gilman, G. (1987). G Proteins: Transducers of Receptor-Generated Signals. Annual Reviews in Biochemistry, 56, 615–649.
- Milligan, G., & Kostenis, E. (2006). Heterotrimeric G-proteins: a short history. British Journal of Pharmacology, 147, 546–555.
- Offermanns, S. (2003). G-proteins as transducers in transmembrane signalling. Progress in Biophysics & Molecular Biology, 83, 101–130.
- Simon, M., Strathmann, M. P., & Gautam, N. (1991). Diversity of G Proteins in Signal Transduction. Science, 252, 802–808.
- Syrovatkina, V., Alegre, K. O., Dey, R., & Huang, X. (2016). Regulation, Signaling, and Physiological Functions of G-Proteins. Journal of Molecular Biology, 428(19), 3850–3868.
