Diferencias entre elementos, compuestos y mezclas (cuadro y ejemplos)
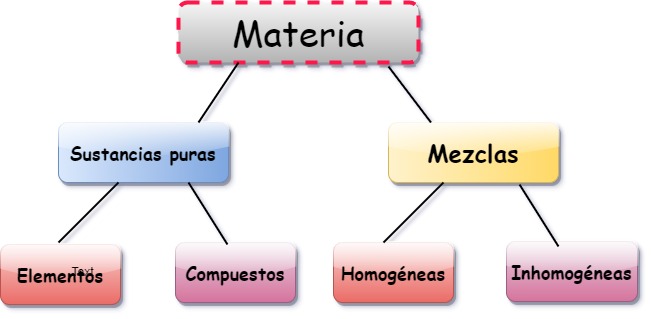
Elementos, compuestos y mezclas son tres formas de presentación de la materia. Los elementos son sustancias constituidas por una sola clase de átomo, los compuestos son combinaciones entre dos o más elementos, y las mezclas resultan de la composición de varios elementos y sustancias.
Los componentes de las mezclas se separan a través de medios físicos. Por su parte, para separar los elementos de un compuesto hay que llevar a cabo procedimientos químicos.
A los elementos no hay forma de separarlos en componentes menores con métodos ordinarios, pero existen formas de fisionar los átomos. De hecho, la fisión es una manera de extraer energía de ellos.
Los átomos que conforman un determinado compuesto lo hacen siempre en proporciones fijas. Por su parte, en una mezcla las proporciones de sus componentes pueden variar. Por ello, a los elementos y compuestos se les considera como sustancias puras, cuya composición es constante y bien definida.
Por ejemplo, la sal de mesa o cloruro de sodio es un compuesto en el que participan átomos de cloro y de sodio, en proporción de uno a uno. Mientras, la leche es una mezcla de composición variable, en la que cada componente mantiene su identidad.
El siguiente cuadro reúne sus principales características:
Elemento | Compuesto | Mezcla | |
Definición | Sustancia que no puede ser descompuesta en otras sustancias más simples. | Sustancia constituida por dos o más elementos distintos. | Sustancia hecha al mezclar otras sustancias. |
Composición | Átomos del mismo tipo. | Dos o más átomos diferentes, siempre en las mismas proporciones. | Combinaciones de elementos y compuestos. |
Separación de componentes | Normalmente no se separan en elementos distintos, con excepción de los elementos radiactivos. | Los componentes se pueden separar a través de procesos químicos. | La separación es posible con medios mecánicos. |
Identificación de componentes | Cada elemento es único. | Sus características difieren de las de sus componentes. | Los componentes de las mezclas siempre mantienen su identidad. |
Representación | Se simbolizan en una o dos letras. | A través de una fórmula que emplea los símbolos de los elementos y la proporción en que cada uno se presenta. | Se denomina con nombres propios. |
Ejemplos | Hidrógeno (H), Silicio (Si), Helio (He), Oro (Au), Potasio (K). | Cloruro de sodio (NaCl), Amoníaco (NH3), Hidruro de sodio (NaH), Dióxido de nitrógeno (NO2). | Sangre, leche, aire, cemento. |
Elementos
Definición
Los elementos son sustancias puras, simples, en cuya composición solo intervienen átomos de un mismo tipo. El comportamiento químico de cada elemento es característico y no hay dos iguales, si bien existen características comunes entre grupos de elementos.
No es posible descomponer un elemento en otro más simple, salvo por procedimientos especiales, como bombardearlo con neutrones para que se desintegre.
El proceso de desintegración ocurre espontáneamente en algunas sustancias como el radio, ciertas variedades de uranio, torio y otros elementos llamados radiactivos.
Composición
Los elementos están formados por átomos idénticos. Estos, a su vez, se conforman por tres clases de partículas: electrones, protones y neutrones. Los electrones y protones tienen masa y carga eléctrica, negativa y positiva respectivamente. Los neutrones tienen masa, pero no carga.
El átomo consiste en un núcleo atómico formado por protones y neutrones, mientras que los electrones se distribuyen en orbitales a su alrededor. Un elemento se distingue de otro por el número de protones que tiene su núcleo, llamado número atómico.
Mientras este permanezca constante, se trata del mismo elemento, aun si el número de neutrones y electrones cambia, ya que en tal caso se tienen los isótopos.
Identificación de componentes
Se emplean técnicas diversas y complejas, por ejemplo, para “ver” los electrones del átomo existen microscopios especiales, como el microscopio de efecto túnel.
Técnica de separación
El átomo de un elemento no se separa a través de métodos químicos, sino que se bombardea con partículas más pequeñas, generalmente neutrones, en un proceso llamado fisión nuclear. Pero, aunque en teoría todo átomo es fisionable, es más fácil hacerlo con los átomos que tienen núcleos pesados, como el uranio-235.
Tipos de elementos
Hay 118 elementos, ubicados en la tabla periódica, ordenados por número atómico. De estos, 92 se encuentran en la naturaleza y los restantes se obtienen en el laboratorio.
Se distribuyen en tres grupos:
- Metales, con electrones libres que los hacen buenos conductores del calor y la electricidad, casi siempre sólidos (salvo el mercurio) y de alta densidad.
- No metales, carecen de propiedades conductoras, se presentan en estado sólido o gaseosos, excepto el bromo, y su densidad es menor.
- Metaloides, elementos con características intermedias entre metales y no metales.
Representación gráfica
Cada elemento de la tabla periódica se simboliza con letras. Por ejemplo, el H, O, C y Fe corresponden respectivamente al hidrógeno, el oxígeno, el carbono y el hierro.
Ejemplos de elementos
Además de los mencionados, se tienen los siguientes elementos, con su símbolo entre paréntesis:
- Cloro (Cl)
- Mercurio (Hg)
- Fósforo (P)
- Yodo (I)
- Magnesio (Mg)
Compuestos
Definición
Los compuestos son sustancias puras, en cuya composición intervienen dos o más tipos de átomos diferentes, en determinadas proporciones, para formar moléculas. Las uniones entre los átomos se llevan a cabo mediante enlaces, que son un factor determinante en las propiedades del compuesto.
Los principales enlaces son:
- Iónicos
- Metálicos
- Covalentes
Composición
Los compuestos constan de dos o más tipos de átomos, siempre en proporción fija.
Identificación de componentes
Cada compuesto tiene propiedades que lo hacen único, que difieren de las de sus elementos constituyentes, porque estos pierden su identidad al formar el compuesto. Por ejemplo, a temperatura ambiente el hidrógeno y el oxígeno son gases, que, al combinarse, dan lugar al agua.
Técnica de separación
Normalmente los compuestos se separan mediante reacciones químicas, aunque la radiación electromagnética, incluyendo la luz, también es capaz de disociar moléculas.
Tipos de compuestos
Los compuestos se dividen en dos grandes categorías:
- Inorgánicos
- Orgánicos
La diferencia radica en que los compuestos orgánicos se basan en el elemento carbono, cuando forma enlaces de tipo covalente con el hidrógeno. El carbono participa de igual modo en muchos compuestos inorgánicos, formando otros enlaces.
Representación gráfica
Se hace a través de su fórmula química, en la que se especifican sus constituyentes, con su respectivo símbolo y la proporción en que participan. Los compuestos tienen, asimismo, diversos nombres.
Ejemplos de compuestos
- Cloruro de sodio o sal de mesa (NaCl)
- Bicarbonato de sodio (NaHCO₃)
- Amoníaco (NH3)
- Carbonato de calcio (CaCo3)
- Glucosa (C₆H₁₂O₆)
Mezclas
Definición
Combinación de dos o más elementos y/o compuestos, sin proporciones definidas, manteniendo cada uno su identidad, es decir, sin que sus propiedades cambien al formar parte de la mezcla.
Composición
Es variable.
Identificación de componentes
Es más simple de llevar a cabo, pues los componentes mantienen su identidad.
Técnica de separación
Los componentes de una mezcla pueden separarse por algún método físico o mecánico, como filtrado o centrifugación, por ejemplo.
Tipos de mezclas
Las mezclas se clasifican en:
- Homogéneas: las partículas componentes son indistinguibles, pese a ser de distintas sustancias. Por ejemplo, azúcar bien disuelto en agua.
- Heterogéneas: mezclas en las que sí se distinguen las partículas, incluso a simple vista, como arena y sal, o sal mezclada con limaduras de metal.
Representación gráfica
Las mezclas carecen de una fórmula definida, pero muchas tienen nombres propios.
Ejemplos de mezclas
- Cemento
- Salsa de tomate
- Madera
- Aire
- Leche
- Concreto
- Sangre
