Serina: características, funciones, metabolismo, alimentos
La serina es uno de los 22 aminoácidos básicos, aunque este no está catalogado como un aminoácido esencial para el hombre y otros animales, puesto que es sintetizado por el cuerpo humano.
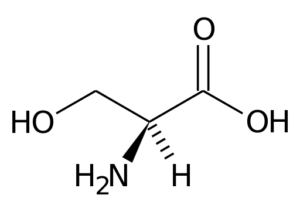
De acuerdo con la nomenclatura de tres letras, la serina se describe en la literatura como Ser (S en el código de una sola letra). Este aminoácido participa en un gran número de rutas metabólicas y tiene características polares, pero no posee carga a pH neutro.
Muchas enzimas importantes para las células poseen abundante concentración de residuos de serina en sus sitios activos, por lo que dicho aminoácido tiene múltiples implicaciones fisiológicas y metabólicas.
La serina, entre muchas de sus funciones, participa como molécula precursora y de andamiaje en la biosíntesis de otros aminoácidos como la glicina y la cisteína y es parte de la estructura de los esfingolípidos presentes en las membranas celulares.
La tasa de síntesis de serina varía en cada órgano y, además, esta cambia según la etapa de desarrollo en que se encuentre el individuo.
Científicos han propuesto que las concentraciones de L-serina en el tejido cerebral aumentan con la edad, ya que la permeabilidad de la barrera hematoencefálica disminuye en el cerebro del adulto, pudiendo causar trastornos cerebrales severos.
Se sabe que la L-serina es vital para la biosíntesis de neurotransmisores, fosfolípidos y otras macromoléculas complejas, ya que proporciona los precursores para estas múltiples vías metabólicas.
Diversos estudios han demostrado que el suministro de suplementos o concentrados de L-serina a cierto tipo de pacientes mejora la homeostasis de la glucosa, la función mitocondrial y reducen la muerte neuronal.
Índice del artículo
- 1 Características y estructura
- 2 Funciones
- 3 Biosíntesis
- 4 Metabolismo
- 5 Alimentos ricos en serina
- 6 Enfermedades relacionadas
- 7 Referencias
Todos los aminoácidos poseen como estructura básica un grupo carboxilo y un grupo amino unidos al mismo átomo de carbono; sin embargo, estos se diferencian entre sí por sus cadenas laterales, conocidas como grupos R, que pueden variar en su tamaño, estructura e incluso en su carga eléctrica
La serina contiene tres átomos de carbono: un carbono central unido, por un lado, a un grupo carboxilo (COOH) y por otro, a un grupo amino (NH3+). Los otros dos enlaces del carbono central están ocupados por un átomo de hidrógeno y por un grupo CH2OH (grupo R), característico de la serina.
El carbono central al que se unen los grupos amino y carboxilo de los aminoácidos se conoce como el carbono α. Los demás átomos de carbono de los grupos R se designan con las letras del alfabeto griego.
En el caso de la serina, por ejemplo, el único átomo de carbono de su grupo R, que está unido al grupo OH, se conoce como carbono γ.
La serina se clasifica dentro del grupo de los aminoácidos polares sin carga. Los miembros de este grupo son aminoácidos muy solubles en agua, es decir, que son compuestos hidrofílicos. En la serina y la treonina, la hidrofilicidad se debe a su capacidad de formar puentes de hidrógeno con el agua a través de sus grupos hidroxilo (OH).
Dentro del grupo de aminoácidos polares sin carga también se agrupan la cisteína, la asparagina y la glutamina. Todos estos poseen un grupo polar en su cadena R, sin embargo, dicho grupo no es ionizable y a pH cercanos a la neutralidad anulan sus cargas produciendo un compuesto en forma de “zwitterion”.
La asimetría general de los aminoácidos hace que la estereoquímica de estos compuestos sea de vital importancia en las rutas metabólicas en las que participan. En el caso de la serina, esta puede encontrarse como D- o L-serina, siendo esta última sintetizada exclusivamente por las células del sistema nervioso conocidas como astrocitos.
Los carbonos α de los aminoácidos son carbonos quirales, puesto que poseen cuatro sustituyentes diferentes unidos, lo que genera que existan al menos dos estereoisómeros distinguibles para cada aminoácido.
Un estereoisómero es una imagen especular de una molécula, es decir, que no se puede superponer una sobre la otra. Se denotan con la letra D o L ya que de forma experimental las soluciones de estos aminoácidos rotan el plano de luz polarizada en direcciones opuestas.
La L-serina que es sintetizada en células del sistema nervioso sirve como sustrato para sintetizar glicina o D-serina. La D-serina es uno de los elementos más importantes para que ocurra el intercambio de vesículas entre neuronas, por lo que algunos autores proponen que ambas isoformas de la serina son, en realidad, aminoácidos esenciales para las neuronas.
El grupo OH de la serina en su cadena R la hace un buen nucleófilo, por lo que es clave para la actividad de muchas enzimas con serinas en sus sitios activos. La serina es uno de los sustratos necesarios para la síntesis de nucleótidos NADPH y glutatión.
La L-serina es indispensable para el desarrollo y correcto funcionamiento del sistema nervioso central. Estudios han demostrado que el suministro exógeno de L-serina en dosis bajas a neuronas del hipocampo y células de Purkinje in vitro, mejora su supervivencia.
Diversos estudios de las células cancerosas y de linfocitos han encontrado que las unidades de carbono dependientes de serina son necesarias para la producción desmedida de nucleótidos, así como de la subsecuente proliferación de las células cancerosas.
La selenocisteína forma parte de los 22 aminoácidos básicos y se obtiene únicamente como un derivado de la serina. Este aminoácido se ha observado sólo en algunas proteínas, contiene selenio en lugar de azufre unido a la cisteína y se sintetiza partiendo de una serina esterificada.
La serina es un aminoácido no esencial, dado que es sintetizado por el cuerpo humano. Sin embargo, este puede ser asimilado a partir de la dieta de diferentes fuentes como las proteínas y los fosfolípidos, principalmente.
La serina se sintetiza en su forma L por medio de la conversión de una molécula de glicina, reacción mediada por una enzima hidroximetil-transferasa.
Se sabe que el principal lugar de síntesis de L-serina es en los astrocitos y no en las neuronas. Es estas células, la síntesis ocurre por una ruta de fosforilación en la que participa el 3-fosfoglicerato, un intermediario glucolítico.
En dicha ruta actúan tres enzimas: la 3-fosfoglicerato deshidrogenasa, la fosfoserina-transferasa y la fosfoserina-fosfatasa.
Otros órganos importantes en lo que a la síntesis de serina se refiere son el hígado, los riñones, los testículos y el bazo. Las enzimas que sintetizan serina por vías distintas a la fosforilación solo se encuentran en el hígado y en los riñones.
Una de las primeras rutas de síntesis de la serina que se conoció fue la vía catabólica involucrada en la gluconeogénesis, en donde se obtiene L-serina como un metabolito secundario. Sin embargo, el aporte de esta ruta a la producción de serina corporal es bajo.
Actualmente se sabe que la serina puede ser obtenida a partir del metabolismo de carbohidratos en el hígado, donde se produce ácido D-glicérico, ácido 3-fosfoglicérico y ácido 3-fosfohidroxipirúvico. Gracias a un proceso de transaminación entre el ácido 3-hidroxi pirúvico y la alanina se produce serina.
Experimentos realizados con ratas marcando radiactivamente el carbono 4 de la glucosa, han concluido que este carbono se incorpora efectivamente en los esqueletos carbonados de la serina, sugiriendo que dicho aminoácido posee un precursor de tres carbonos probablemente procedente del piruvato.
En las bacterias, la enzima L-serina-desaminasa es la principal enzima encargada de metabolizar a la serina: convierte la L-serina en piruvato. Se sabe que esta enzima está presente y activa en cultivos de E. coli crecidas en medios mínimos con glucosa.
No se sabe a ciencia cierta cuál es la función real de la L-serina-desaminasa en estos microorganismos, puesto que su expresión es inducida por efectores mutacionales que dañan el ADN por radiación ultravioleta, por la presencia de ácido nalidíxico, mitomicina y otros, por lo que se deduce que debe tener implicaciones fisiológicas importantes.
Todos los alimentos con altas concentraciones de proteínas son ricos en serina, principalmente huevos, carnes y pescados. Sin embargo, este es un aminoácido no esencial, por lo que no es estrictamente necesario ingerirlo, en vista de que el cuerpo es capaz de sintetizarlo por sí mismo.
Algunas personas padecen de un trastorno poco común, ya que presentan un fenotipo con deficiencia respecto a los mecanismos de síntesis de la serina y la glicina, por tanto, necesitan ingerir complementos alimenticios concentrados para ambos aminoácidos.
Además, marcas comerciales especializadas en la venta de suplementos vitamínicos (Lamberts, Now Sport y HoloMega) ofrecen concentrados de fosfatidilserina y L-serina para incrementar la producción de masa muscular en los atletas de alta competencia y levantadores de pesas.
El mal funcionamiento de las enzimas implicadas en la biosíntesis de la serina puede provocar patologías graves. Al disminuir la concentración de serina en el plasma sanguíneo y el líquido cefalorraquídeo, puede provocar hipertonía, retraso psicomotor, microcefalia, epilepsia y trastornos complejos del sistema nervioso central.
Actualmente se ha descubierto que la deficiencia de serina está implicada en el desarrollo de diabetes mellitus, ya que la L-serina es necesaria para la síntesis de la insulina y la de sus receptores.
Los bebés que presentan defectos en la biosíntesis de serina son neurológicamente anormales al nacer, presentan retrasos en el crecimiento intrauterino, microcefalia congénita, cataratas, convulsiones y un grave retraso en el desarrollo neurológico.
- Elsila, J. E., Dworkin, J. P., Bernstein, M. P., Martin, M. P., & Sandford, S. A. (2007). Mechanisms of amino acid formation in interstellar ice analogs. The Astrophysical Journal, 660(1), 911.
- Ichord, R. N., & Bearden, D. R. (2017). Perinatal metabolic encephalopathies. In Swaiman’s Pediatric Neurology (pp. 171-177). Elsevier.
- Mothet, J. P., Parent, A. T., Wolosker, H., Brady, R. O., Linden, D. J., Ferris, C. D., … & Snyder, S. H. (2000). D-serine is an endogenous ligand for the glycine site of the N-methyl-D-aspartate receptor. Proceedings of the National Academy of Sciences, 97(9), 4926-4931
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Rodríguez, A. E., Ducker, G. S., Billingham, L. K., Martinez, C. A., Mainolfi, N., Suri, V., … & Chandel, N. S. (2019). Serine Metabolism Supports Macrophage IL-1β Production. Cell metabolism, 29(4), 1003-1011.
- Tabatabaie, L., Klomp, L. W., Berger, R., & De Koning, T. J. (2010). L-serine synthesis in the central nervous system: a review on serine deficiency disorders. Molecular genetics and metabolism, 99(3), 256-262.
