Óxido de cromo (III): estructura, nomenclatura, propiedades, usos
El óxido de cromo (III) u óxido crómico es un sólido inorgánico de color verde que se forma quemando el metal cromo (Cr) en oxígeno (O2), quedando el cromo con estado de oxidación 3+. Su fórmula química es Cr2O3. En la naturaleza se encuentra en el mineral eskolaíta. No se conocen depósitos naturales aprovechable de óxido de cromo (III).
Se puede preparar entre otras maneras calentando Cr2O3 hidratado (Cr2O3.nH2O) para remover completamente el agua. También se obtiene como producto de la calcinación del óxido de cromo(VI) (CrO3).

Sin embargo, la mejor forma de obtenerlo puro es por descomposición del dicromato de amonio (NH4)2Cr2O7 a 200 ºC. Industrialmente se produce por reducción del dicromato de sodio (Na2Cr2O7) sólido con azufre.
Cuando se encuentra finamente dividido presenta un color verde brillante con matiz amarillento. Pero si las partículas son de mayor tamaño exhibe un tinte azulado. El óxido crómico es el pigmento verde más estable que se conozca. Su resistencia térmica y química lo convierte en un valioso colorante de cerámica.
Se emplea en revestimientos industriales, barnices, en la industria de la construcción, en joyería, como colorante en cosméticos o en productos farmacéuticos, entre otras aplicaciones.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Usos
- 4.1 En la industria de la cerámica y vidrio
- 4.2 En revestimientos industriales
- 4.3 En la industria de los refractarios
- 4.4 En construcción
- 4.5 Como pigmento en variadas aplicaciones
- 4.6 En joyería
- 4.7 En catálisis de reacciones químicas
- 4.8 En la fabricación del cromo
- 4.9 En materiales magnéticos
- 4.10 Innovaciones recientes
- 5 Referencias
El óxido α-Cr2O3 posee la estructura tipo corindón. Su sistema cristalino es hexagonal romboédrico. Es isomorfo con el α-alúmina y α-Fe2O3.
La eskolaíta, mineral natural del óxido de cromo (III), presenta la estructura que se muestra a continuación:
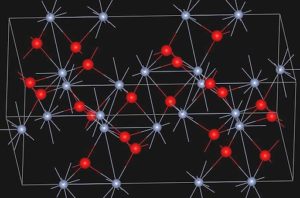
– Óxido de cromo (III).
– Óxido de cromo verde.
– Trióxido de dicromo.
– Sesquióxido de cromo.
– Cromia.
– Eskolaíta: Mineral de óxido de cromo (III).
– El hidrato: Cr2O3.nH2O (donde n ≅ 2) se denomina hidrato de óxido de cromo (III) o Verde de Guignet.

Sólido cristalino.
9 (sus cristales son extremadamente duros).
151,99 g/mol.
Funde a 2435 ºC, pero se comienza a evaporar a 2000 ºC formando nubes de humo verde.
5,22 g/cm3
Cuando ha sido calentado a altas temperaturas resulta prácticamente insoluble en agua (3 microgramos/L a 20ºC); insoluble en alcoholes y acetona; ligeramente soluble en ácidos y álcalis; sSoluble en ácido perclórico (HClO4) al 70%, en el cual se descompone.
6.
2,551.
– Si se calcina fuertemente se vuelve inerte hacia ácidos y bases. De otra forma el Cr2O3 y su forma hidratada Cr2O3.nH2O son anfotéricos, disolviéndose fácilmente en ácido para dar aqua-iones [Cr(H2O)6]3+, y en álcali concentrado para formar “cromitos”.
– Cuando se ha calcinado, es resistente químicamente a ácidos, álcalis y altas temperaturas. Es extremadamente estable al SO2.
– Posee una resistencia sobresaliente a la luz debido a que sus cristales presentan opacidad, alta atenuación UV y transparencia a la luz visible.
– Es un material extremadamente duro, puede rayar el cuarzo, topacio y circonio.
– Su hidrato Cr2O3.nH2O (donde n ≅ 2) no tiene estabilidad térmica, su agua de hidratación limita su aplicabilidad a menos de 260 ºC. Presenta baja capacidad de teñido y rango limitado de matices.
– Pero dicho hidrato posee una tonalidad verde-azulada muy limpia y brillante. Es semitransparente, presenta baja opacidad, excelente resistencia a la luz y resistencia a los álcalis.
– El Cr2O3 no se clasifica como material peligroso y se considera un polvo fino inerte. No está sujeto a regulaciones internacionales de transporte.
– No irrita la piel ni las mucosas.
Debido su alta resistencia al calor y resistencia química, el Cr2O3 calcinado se emplea como colorante o pigmento vitrificable en la fabricación de cerámica, en esmaltes de porcelana y mezclas para vidrios.
La cerámica con óxido de cromo (III) proporciona una excelente resistencia contra la mayoría de ambientes corrosivos. Todo ello mediante el mecanismo de exclusión del sustrato del ambiente que lo rodea.
Por esta razón, se usa en revestimientos para prevenir la corrosión de muchos materiales, siendo aplicado mediante pulverización térmica (atomización o rocío en caliente).
También se emplea como protección contra el desgaste abrasivo (cuando la remoción del material es ocasionado por partículas que se mueven a través de una superficie).
En estos casos, la aplicación de un recubrimiento de Cr2O3 mediante deposición con plasma, genera una alta resistencia a la abrasión.
Los dos casos anteriores tienen utilidad, por ejemplo, en motores de turbinas de gas de la industria aeroespacial.
Se emplea en la producción de ladrillos térmica y químicamente resistentes, materiales de revestimiento y concreto refractario basado en alúmina.
Dado que es extremadamente resistente a las condiciones atmosféricas, luz y calor, se aplica como colorante de roca granulada para techos de asfalto, cemento concreto, recubrimientos industriales de alta calidad para exteriores, construcciones de acero y recubrimiento de fachadas (pinturas emulsionables).
Puede soportar condiciones de vulcanización y no se degrada, por lo que se emplea en la pigmentación de gomas.
Por ser no-tóxico se usa como pigmento para juguetes, cosméticos (especialmente su hidrato), plásticos, tintas de impresión, pinturas que entran en contacto con alimentos y productos farmacéuticos.
En la industria de los pigmentos se utiliza como materia prima para producir tintes penetrantes que contienen cromo y en pigmentos basados en fases de óxidos metálicos mixtos. También se emplea como colorante de pinturas para el recubrimiento de bobinas.
Su hidrato posee una transparencia que permite la formulación de acabados policromáticos en la industria automotriz (acabados metálicos de automóviles).
Por su característica única de reflejar la radiación infrarroja (IR) de forma similar a la clorofila de las plantas, bajo luz infrarroja parece follaje. Por esta razón, es muy extendido su uso en pinturas o revestimientos de camuflaje para aplicaciones militares.
Se emplea como colorante de gemas sintéticas. Cuando se introduce Cr2O3 como impureza en la red cristalina del α-Al2O3, como en el mineral semi-precioso rubí, el color es rojo en lugar de verde.
También se utiliza como agente de molienda y pulido por su alta dureza y propiedades abrasivas.
Soportado en alúmina (Al2O3) u otros óxidos, se emplea en química orgánica como catalizador, por ejemplo, en la hidrogenación de ésteres o aldehídos para formar alcoholes y en la ciclización de hidrocarburos. Cataliza la reacción del nitrógeno (N2) con el hidrógeno (H2) para formar amoniaco (NH3).
Por su capacidad de óxido-reducción actuando junto con el óxido de cromo(VI) juega un rol importante en la deshidrogenación de alcanos con CO2 para producir propeno e isobuteno, ya que el ciclo desactivación-reactivación del catalizador es fácilmente ejecutable. También se usa como catalizador en química inorgánica.
Se utiliza en la producción aluminotérmica del metal de cromo puro. Para ello debe ser calentado a 1000 ºC con la finalidad de aumentar su tamaño de grano.

Ha sido añadido en pequeñas cantidades a materiales magnéticos de cintas de audio y vídeo impartiendo un efecto autolimpiante a los cabezales de sonido.
Se ha logrado obtener pigmentos que tienen reflectancia mejorada del cercano IR al dopar nanopartículas de Cr2O3 con sales de elementos pertenecientes al grupo de las tierras raras, como el lantano y el praseodimio.
Aumentando la concentración de dichos elementos, aumenta la reflectancia solar del infrarrojo cercano sin afectar el color verde del pigmento de Cr2O3.
Esto permite clasificar al Cr2O3 dopado como pigmento “frío”, pues resulta adecuado para controlar la acumulación de calor.
Aplicado a techos, automóviles y tapicería, entre otras aplicaciones, logra una alta reflectancia de luz solar IR, lo que permite reducir considerablemente el aumento de calor en los ambientes.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Volume 19. Fourth Edition. John Wiley & Sons.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. Volume A7 and A20. VCH Verlagsgesellschaft mbH.
- American Elements. (2019). Chromium(III) Oxide. Recuperado de americanelements.com.
- National Library of Medicine. (2019). Chromium(III) Oxide. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Dorfman, Mitchell R. (2012). Thermal Spray Coatings. In Handbook of Environmental Degradation of Materials. Chapter 19. Recuperado de sciencedirect.com.
- Takehira, K. et al. (2004). CO2 Dehydrogenation of Propane over Cr-MCM-41 Catalyst. In Studies in Surface Science and Catalysis 153. Recuperado de sciencedirect.com.
- Selvam Sangeetha et al. (2012). Functional pigments from chromium(III) oxide nanoparticles. Dyes and Pigments 94 (2012) 548-552. Recuperado de sciencedirect.com.
