Óxido de silicio (SiO2): estructura, propiedades, usos, obtención
El óxido de silicio es un sólido inorgánico formado por la unión de un átomo de silicio y dos de oxígeno. Su fórmula química es SiO2. A este compuesto natural se le denomina también sílice o dióxido de silicio.
El SiO2 es el mineral más abundante en la corteza terrestre, ya que la arena está compuesta de sílice. Según su estructura la sílice puede ser cristalina o amorfa. Es insoluble en agua, pero se disuelve en álcalis y en ácido fluorhídrico HF.

El SiO2 también está presente en la estructura de ciertas plantas, bacterias y hongos. También en esqueletos de organismos marinos. Además de la arena, también hay otros tipos de piedras que son de sílice.
La sílice tiene un uso muy extendido cumpliendo variedad de funciones. El uso más generalizado es como material filtrante de líquidos como aceites y productos del petróleo, bebidas como la cerveza y el vino, así como también jugos de frutas.
Pero tiene muchas otras aplicaciones. Una de las más útiles e importantes es en la fabricación de vidrios bioactivos, los cuales permiten hacer “andamios” donde crecen células óseas para producir piezas óseas faltantes por accidente o enfermedad.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Presencia en la naturaleza
- 5 Obtención
- 6 Usos
- 7 Riesgos
- 8 Referencias
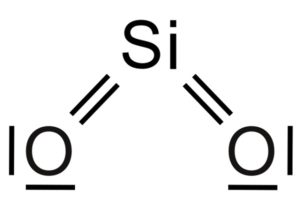
El dióxido de silicio SiO2 es una molécula de tres átomos, en la cual el átomo de silicio se encuentra unido a dos átomos de oxígeno con enlaces covalentes.
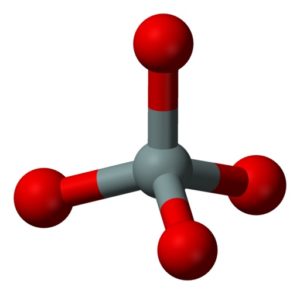
La unidad estructural de la sílice sólida como tal es un tetraedro donde un átomo de silicio está rodeado de 4 átomos de oxígeno.
Los tetraedros se unen entre sí compartiendo los átomos de oxígeno de sus vértices contiguos.
Es por ello que un átomo de silicio comparte por la mitad cada uno de los 4 átomos de oxígeno y esto explica la relación en el compuesto de 1 átomo de silicio a 2 átomos de oxígeno (SiO2).

Los compuestos de SiO2 se dividen en dos grupos: sílice cristalina y sílice amorfa.
Los compuestos de sílice cristalina tienen estructuras con patrones repetitivos de silicio y oxígeno.
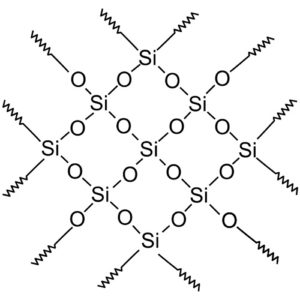
Todo el cristal de sílice puede considerarse como una molécula gigante donde la red cristalina es muy fuerte. Los tetraedros pueden enlazarse de diversas maneras, dando origen a diversas formas cristalinas.
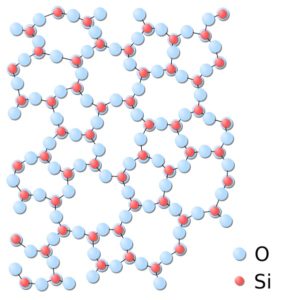
En la sílice amorfa, las estructuras están unidas al azar, sin seguir un patrón regular definido entre las moléculas y estas están en una relación espacial diferente la una con la otra.
-Óxido de silicio
-Dióxido de silicio
-Sílice
-Cuarzo
-Tridimita
-Cristobalita
-Dioxosilano
Sólido de incoloro a gris.

60,084 g/mol
1713 ºC
2230 ºC
2,17-2,32 g/cm3
Insoluble en agua. La sílice amorfa es soluble en álcalis, especialmente si está finamente dividida. Soluble en ácido fluorhídrico HF.
La sílice amorfa es menos hidrofílica, es decir, menos afín al agua que la cristalina.
El SiO2 o sílice es esencialmente inerte a la mayoría de sustancias, es muy poco reactivo.
Resiste el ataque del cloro Cl2, bromo Br2, hidrógeno H2 y de la mayoría de los ácidos a temperatura ambiente o ligeramente superior. Es atacada por el flúor F2, el ácido fluorhídrico HF y por los álcalis como el carbonato de sodio Na2CO3.
El SiO2 se puede combinar con elementos metálicos y óxidos para formar silicatos. Si se funde sílice con carbonatos de metales alcalinos a aproximadamente 1300 °C se obtienen silicatos alcalinos y se desprende CO2.
No es combustible. Tiene baja conductividad térmica.
La principal fuente de sílice en la naturaleza es la arena.
El SiO2 o sílice se encuentra en forma de tres variedades cristalinas: cuarzo (la más estable), tridimita y cristobalita. Formas amorfas de la sílice son el ágata, el jaspe y el ónice. El ópalo es una sílice hidratada amorfa.
También existe la denominada sílice biogénica, es decir, la generada por organismos vivos. Fuentes de este tipo de sílice son las bacterias, los hongos, las diatomeas, las esponjas marinas y las plantas.
Las partes brillantes y duras del bambú y la paja contienen sílice, y los esqueletos de algunos organismos marinos también tienen gran proporción de sílice; sin embargo, las más importantes son las tierras de diatomeas.
Las tierras de diatomeas son productos geológicos de organismos unicelulares decaídos (algas).
En la naturaleza también existen las siguientes variedades:
– Las sílices vítreas que son vidrios volcánicos
– Las lechaterielitas que son vidrios naturales producidos por la fusión de material silíceo bajo el impacto de meteoritos
– La sílice fundida que es sílice calentada hasta la fase líquida y enfriada sin permitir que cristalice
La sílice proveniente de arenas es obtenida directamente de las canteras.

La diatomita o tierra de diatomeas se también se obtiene de esta forma, utilizando excavadoras y equipos similares.
La sílice amorfa se prepara partiendo de soluciones acuosas de silicato de metal alcalino (como el sodio Na) mediante neutralización con ácido, como ácido sulfúrico H2SO4, ácido clorhídrico HCl o dióxido de carbono CO2.
Si el pH final de la solución es neutro o alcalino se obtiene sílice precipitada. Si el pH es ácido se obtiene sílice gel.
La sílice pirogénica se prepara mediante la combustión de un compuesto de silicio volátil, usualmente tetracloruro de silicio SiCl4. La sílice precipitada se obtiene de una solución acuosa de silicatos a la que se le añade ácido.
La sílice coloidal es una dispersión estable de partículas de tamaño coloidal de sílice amorfa en una solución acuosa.
La sílice o SiO2 tiene una gran variedad de funciones, por ejemplo sirve como abrasivo, absorbente, antiapelmazante, relleno, opacificante y para favorecer la suspensión de otras sustancias, entre muchos otros modos de empleo.
Se usa por ejemplo:
-En la manufactura de vidrio, cerámica, refractarios, abrasivos y vidrio soluble
-Decoloración y purificación de aceites y productos del petróleo
-En moldes para fundición
-Como antiapelmazante de polvos de todo tipo
-Como antiespumante
-Para filtrar líquidos como los solventes de lavado en seco, el agua de las piscinas y las aguas residuales municipales e industriales
-En la manufactura de aislantes del calor, ladrillos ignífugos y materiales de empaque resistentes al fuego y a los ácidos
-Como relleno en la manufactura de papeles y cartones, para hacerlos más resistentes
-Como relleno de pinturas para mejorar su flujo y color
-En materiales para pulido de metales y madera, pues les imparte abrasividad
-En laboratorios de análisis químico en cromatografía y como absorbente
-Como antiapelmazante de fórmulas insecticidas y agroquímicos, para ayudar a moler pesticidas cerosos y como portador del compuesto activo
-Como soporte de catalizadores
-Como relleno para reforzar gomas sintéticas y cauchos
-Como portador de líquidos en alimentos para animales
-En tintas de impresión
-Como desecante y adsorbente, en forma de sílice gel
-Como aditivo en el cemento
-Como arena para mascotas
-En aislantes para microelectrónica
-En interruptores termoópticos

La sílice amorfa se incorpora a una variedad de productos alimenticios como ingrediente directo multifuncional en varios tipos de alimentos. No debe exceder el 2% del alimento terminado.
Por ejemplo, sirve como antiapelmazante (para evitar que se peguen ciertos alimentos), como estabilizante en la producción de cerveza, como antiprecipitante, para filtrar vino, cerveza y jugos de frutas o vegetales.

Actúa como absorbente de líquidos en algunos alimentos y componente de microcápsulas para aceites saborizantes.
Además el SiO2 amorfo se aplica mediante un proceso especial sobre la superficie de los plásticos de artículos para empacar alimentos, actuando como barrera.
Se añade como agente antiapelmazante, espesante, gelificante y como excipiente, es decir, como ayudante para dar forma de tabletas a varios fármacos y vitaminas.
Se usa en una multitud de productos: en polvos faciales, sombras para los ojos, delineadores de ojos, lápices labiales, coloretes, removedores de maquillaje, talcos, polvos para los pies, tintes para el cabello y decolorantes.
Además en aceites y sales de baño, baños de espuma, cremas para manos y cuerpo, humectantes, desodorantes, cremas o máscaras faciales (exceptuando cremas de afeitar), perfumes, lociones y cremas de limpieza.
También en cremas de hidratación nocturna, brillos y pinturas para las uñas, lociones para refrescar la piel, tónicos capilares, pasta dentífrica, acondicionadores para el cabello, geles y cremas para bronceado.
El SiO2 está presente en los vidrios bioactivos o biovidrios cuya característica principal es que pueden reaccionar químicamente con el medio biológico que los rodea, formando un enlace fuerte y duradero con el tejido vivo.
Este tipo de material sirve para fabricar sustitutos de huesos como los de la cara, como “andamios” en los cuales crecerán células del hueso. Han demostrado buena biocompatibilidad tanto con huesos como con tejidos suaves.
Estos biovidrios permitirán recuperar huesos de la cara a personas que los han perdido por accidente o enfermedad.
Las partículas de sílice muy finas pueden quedar suspendidas en el aire y formar polvos no explosivos. Pero este polvo puede irritar la piel y los ojos. Su inhalación causa irritación del tracto respiratorio.
Además, la inhalación del polvo de sílice produce a largo plazo un daño progresivo de los pulmones, denominado silicosis.
- U.S. National Library of Medicine. (2019). Silicon dioxide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Da Silva, M.R. et al. (2017). Green Extraction Techniques. Silica-Based Sorbents. In Comprehensive Analytical Chemistry. Recuperado de sciencedirect.com.
- Ylänen, H. (editor). (2018). Bioactive Glasses: Materials, Properties and Applications (Second Edition). Elsevier. Recuperado de books.google.co.ve.
- Windholz, M. et al. (editors) (1983) The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. Tenth Edition. Merck & CO., Inc.
- Mäkinen, J. and Suni, T. (2015). Thick-Film SOI Wafers. In Handbook of Silicon Based MEMS Materials and Technologies (Second Edition). Recuperado de sciencedirect.com.
- Sirleto, L. et al. (2010). Thermo-optical switches. Silicon nanocrystals. Recuperado de sciencedirect.com.
