Fosfuro de aluminio (AIP): estructura, propiedades, usos, riesgos
El fosfuro de aluminio es un compuesto inorgánico formado por un átomo de aluminio (Al) y un átomo de fósforo (P). Su fórmula química el AlP. Es un sólido color gris oscuro o, si está muy puro, amarillo. Es un compuesto extremadamente tóxico para los seres vivos.
El fosfuro de aluminio reacciona con la humedad para formar fosfina o fosfano PH3, el cual es un gas venenoso. Por esta razón, el AlP no debe entrar en contacto con agua. Reacciona fuertemente con ácidos y soluciones alcalinas.

Se utilizó en el pasado para eliminar plagas como insectos y roedores en lugares donde se almacenaban granos de cereales y otros productos agrícolas. Sin embargo, por su alta peligrosidad ha sido prohibido en la mayoría de países del mundo.
Actualmente se investiga de forma teórica su utilidad en el área de electrónica mediante computadoras que calculan la posibilidad de obtener nanotubos de AlP semiconductores, es decir, tubitos extremadamente pequeños que pueden transmitir la electricidad solo bajo ciertas condiciones.
El fosfuro de aluminio es un compuesto muy peligroso, debe manipularse con implementos de seguridad como guantes, lentes, equipos de respiración y ropa de protección.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Usos
- 6 Investigación teórica de nanotubos de AlP
- 7 Riesgos
- 8 Referencias
El fosfuro de aluminio AlP está formado por la unión de un átomo de aluminio Al y un átomo de fósforo P. El enlace entre ambos es covalente y triple, por lo tanto es muy fuerte.
El aluminio en el AlP posee un estado de oxidación de +3 y el fósforo tiene una valencia de -3.
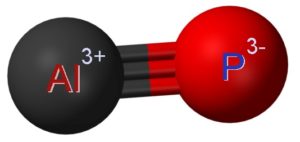
– Fosfuro de aluminio
Sólido cristalino gris oscuro o amarillo oscuro o verde. Cristales cúbicos.
57,9553 g/mol
2550 ºC
2,40 g/cm3 a 25 °C
Se descompone en agua.
Reacciona con la humedad para dar fosfina o fosfano PH3 que es un compuesto inflamable y venenoso. La fosfina o fosfano se incendia espontáneamente en contacto con aire, excepto si hay exceso de agua presente.
La reacción del fosfuro de aluminio con el agua es la siguiente:
Fosfuro de aluminio + Agua → Hidróxido de Aluminio + Fosfina
AlP + 3 H2O → Al(OH)3 + PH3↑
Las presentaciones comerciales tienen carbonato de aluminio Al2(CO3)3 para prevenir la autoignición de la fosfina que se produce cuando el AlP entra en contacto con la humedad del aire.
El AlP es estable cuando está seco. Reacciona violentamente con ácidos y soluciones alcalinas.
El fosfuro de aluminio AlP no se funde, ni sublima ni se descompone térmicamente a temperaturas tan altas como 1000 °C. Aun a esta temperatura su presión de vapor es muy baja, es decir, que no se evapora a esa temperatura.
Cuando se calienta hasta su descomposición emite óxidos de fósforo tóxicos. En contacto con metales puede emitir gases inflamables de hidrógeno H2.
Cuando está puro muestra una coloración amarillenta, cuando está mezclado con restos de la reacción de preparación presenta color desde gris hasta negro.
Su baja volatilidad excluye que tenga algún olor, por lo que el olor de ajo que a veces emite se debe a la fosfina PH3 que se forma en presencia de humedad.
El fosfuro de aluminio se puede obtener calentando una mezcla del metal aluminio (Al) en polvo y el elemento fósforo (P) rojo.
Debido a la afinidad del fósforo (P) por el oxígeno (O2) y la del aluminio (Al) por el oxígeno y el nitrógeno (N2), la reacción debe realizarse en atmósfera libre de estos gases, como por ejemplo en atmósfera de hidrógeno (H2) o de gas natural.
La reacción se inicia calentando rápidamente una zona de la mezcla hasta que se inicia la reacción, la cual es exotérmica (se produce calor durante la misma). A partir de ese momento la reacción procede rápidamente.
Aluminio + Fósforo → Fosfuro de Aluminio
4 Al + P4 → 4 AlP
El fosfuro de aluminio se utilizó en el pasado como insecticida y como exterminador de roedores. Sin embargo, aunque ha sido prohibido por su toxicidad, aún se usa en algunas partes del mundo.
Se emplea para la fumigación en espacios cerrados donde se encuentran productos agrícolas alimenticios procesados o sin procesar (como cereales), alimentos para animales y productos no alimenticios.
El objetivo es controlar insectos y roedores que atacan los artículos almacenados, ya sean comestibles o no.
Permite controlar roedores e insectos en áreas no domésticas, agrícolas o no agrícolas, fumigando en exteriores o en sus madrigueras y nidos para evitar que transmitan ciertas enfermedades.


Su forma de uso consiste en la exposición del AlP al aire o humedad, pues se libera fosfina o fosfano PH3 que genera daños en muchos órganos de la plaga a eliminar.

El fosfuro de aluminio AlP se emplea como fuente de fosfina o fosfano PH3 y se está utilizando en investigación de semiconductores.
Se han realizado estudios teóricos sobre la formación de nanotubos de fosfuro de aluminio AlP. Los nanotubos son cilindros muy pequeños y muy delgados que pueden ser visibles solo con un microscopio electrónico.
Los estudios teóricos realizados mediante cálculos computacionales demuestran que las impurezas que podrían añadirse a los nanotubos de AlP podrían cambiar las propiedades teóricas de estos.
Por ejemplo se estima que el añadir átomos de boro (B) a los nanotubos de AlP podría convertirlos en semiconductores tipo-p. Un semiconductor es un material que se comporta como conductor de la electricidad o como aislante dependiendo del campo eléctrico al cual está sometido.
Y un semiconductor tipo-p es cuando al material se le añaden impurezas, en este caso el AlP es el material de partida y los átomos de boro serían las impurezas. Los semiconductores son útiles para aplicaciones de electrónica.
Algunos científicos han realizado cálculos para determinar el efecto de cambiar la estructura de la red cristalina de los nanotubos de AlP de hexagonal a octaédrica.
Encontraron que la manipulación de la estructura de la red cristalina podría utilizarse para ajustar la conductividad y reactividad de los nanotubos de AlP y diseñarlos de forma que sean útiles para aplicaciones de electrónica y óptica.
El contacto con el fosfuro de aluminio puede irritar la piel, los ojos y las membranas mucosas. Si se ingiere o inhala es tóxico. Puede absorberse a través de la piel con efectos tóxicos.
Si el AlP entra en contacto con agua reacciona y forma fosfina o fosfano PH3 la cual es extremadamente inflamable pues se incendia en contacto con el aire. Por ende puede explotar. Además la fosfina causa la muerte de humanos y animales.
Al ser el fosfuro de aluminio un pesticida económico, su uso es causa común de envenenamiento de las personas y conlleva una alta tasa de mortalidad.

Reacciona con la humedad de las mucosas y con el ácido clorhídrico HCl del estómago formando el muy tóxico gas fosfano PH3. Por lo tanto, por inhalación y por ingestión se forma la fosfina dentro del organismo, con efectos mortales.
Su ingestión causa hemorragia del tracto gastrointestinal, colapso cardiovascular, desórdenes neuropsiquiátricos, falla respiratoria y renal en pocas horas.
El AlP es muy tóxico para todos los animales terrestres y acuáticos.
- U.S. National Library of Medicine. (2019). Aluminum phosphide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. et al. (2007). Aluminum. Other aluminum compounds. In Handbook on the Toxicology of Metals (Third Edition). Recuperado de sciencedirect.com.
- Gupta, R.C. and Crissman, J.W. (2013). Safety Assessment including Current and Emerging Issues in Toxicology Pathology. Human Risk. In Haschek and Rousseaux’s Handbook of Toxicology Pathology (Third Edition). Recuperado de sciencedirect.com.
- White, W.E. and Bushey, A.H. (1944). Aluminum Phosphide – Preparation and Composition. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Recuperado de pubs.acs.org.
- Mirzaei, Maryam and Mirzaei, Mahmoud. (2011). A theoretical study of boron-doped aluminum phosphide nanotubes. Computational and Theoretical Chemistry 963 (2011) 294-297. Recuperado de sciencedirect.com.
- Takahashi, L. and Takahashi, K. (2018). Tuning the Electronic Structure of an Aluminum Phosphide Nanotube through Configuration of the Lattice Geometry. ACS Appl. Nano Mater. 2018, 1, 501-504. Recuperado de pubs.acs.org.
- Gupta, P.K. (2016). Toxic effects of pesticides (agrochemicals). Aluminum Phosphide. In Fundamentals of Toxicology. Recuperado de sciencedirect.com.
