Berkelio (Bk): estructura, propiedades, obtención, usos
El berkelio es un elemento químico cuyo símbolo es Bk. Pertenece a la clase de los actínidos, siendo su octavo miembro. Su número atómico es 97. Se trata de un sólido metálico sintético. Este elemento no se encuentra de forma natural sobre la corteza terrestre. Está presente en pequeñas cantidades en combustibles nucleares gastados y presenta un brillo plateado.
También hay pequeñas cantidades dispersadas en el ambiente por las pruebas de las armas nucleares, por los accidentes graves en instalaciones de energía atómica como Chernobyl y por la liberación que ocurre a partir de los desechos provenientes de las plantas de energía nuclear.

No se ha encontrado una utilidad práctica para el berkelio, debido a que se produce en muy pequeñas cantidades y al hecho de que todos sus isótopos (átomos de Bk con diferente número de neutrones en el núcleo) son radiactivos. Su principal aplicación hasta ahora ha sido en estudios científicos.
Aunque sus isótopos son producidos artificialmente en laboratorios especiales y son manejados por personal experto, debe tenerse siempre en cuenta los daños que puede causar la peligrosa radiación que emiten.
Índice del artículo
- 1 Nomenclatura
- 2 Descubrimiento
- 3 Estructura electrónica
- 4 Obtención
- 5 Propiedades físicas del berkelio
- 6 Propiedades químicas
- 7 Isótopos
- 8 Usos
- 9 Riesgos
- 10 Referencias
- Berkelio, símbolo Bk.
- Berkelio-243, Bk-243 o 243Bk: isótopo del berkelio con masa atómica 243.
Fue producido por primera vez en 1949 por los científicos Glen Seaborg, Stanley G. Thompson y Al Ghiorso en la Universidad Berkeley de California, cuando bombardearon el americio-241 con partículas alfa de alta energía utilizando un ciclotrón (un acelerador de partículas).
Inmediatamente después de la irradiación el material se disolvió adecuadamente y se hizo pasar a través de una columna de resina de intercambio iónico, empleando como eluyente una solución de citrato de amonio.
De esta forma obtuvieron un isótopo del elemento número 97 con masa atómica de 243, que emite partículas alfa y posee una vida media de 4,5 horas.
Al principio varios investigadores propusieron que el elemento tomara el nombre de uno de sus descubridores, Glen Seaborg, pues este tenía el mérito de haber logrado sintetizar 10 elementos en varios años de trabajo.
Sin embargo, la organización oficial Unión Internacional de Química Pura y Aplicada o IUPAC (siglas del inglés International Union of Pure and Applied Chemistry) decidió asignarle el nombre “berkelio” por haber sido obtenido en la universidad y ciudad de Berkeley (California).

El nombre Berkeley proviene del filósofo angloirlandés George Barkeley, nombre cuya pronunciación cambió luego en Estados Unidos cuando se fundó la ciudad y la universidad en 1869.
Ese casualmente fue el año en que Dmitri Mendeléyev publicó su primera tabla periódica y comenzó a predecir la existencia de nuevos elementos como el berkelio.
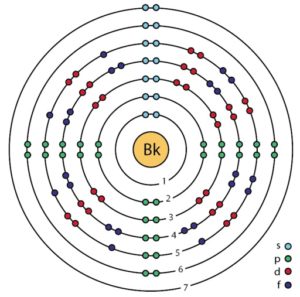
Su configuración electrónica es:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10 4f14; 5s2 5p6 5d10; 6s2 6p6; 5f9 7s2,
o en forma compacta:
[Rn] 5f9 7s2.
La primera muestra del metal se preparó en 1969 mediante una reacción de reducción del fluoruro (BkF3) con metal litio (Li) a una temperatura de 1300 K.
Para preparar láminas delgadas del metal se reduce el óxido BkO2 con torio (Th) o lantano (La) metálico.
Sólido metálico de apariencia plateada.
El metal berkelio tiene dos formas cristalinas: alfa (hexagonal doble compacta) y beta (cúbica centrada en las caras).
247
1050 ºC (forma alfa)
986 °C (forma beta)
2627 ºC
14,78 g/cm3 (forma alfa)
13,25 g/cm3 (forma beta)
Según algunas fuentes ciertos compuestos de berkelio muestran propiedades paramagnéticas, lo que significa que son atraídos por los campos magnéticos.
Esta característica es de tipo paramagnética porque al suspender la acción magnética el material no logra mantener tales propiedades por sí solo.
A temperaturas elevadas el berkelio metálico se oxida rápidamente en aire u oxígeno, formando sus óxidos. Es fácilmente soluble en ácidos minerales, liberando gas hidrógeno H2 y formando iones Bk3+.
Las investigaciones iniciales de este elemento se limitaron a experimentos de intercambio iónico y coprecipitación, con los que se logró observar que el estado de oxidación +3 es estable y el +4 es accesible en solución acuosa, pues el Bk3+ puede ser oxidado por el ion bromato (BrO4–) para dar Bk4+.
En 2017 se reportó la estabilización del Bk4+ en solución utilizando el compuesto formado por grupos hidroxipiridinona unidos a una estructura de poliamina (llamado ligando 3,4,3-LI(1,2-HOPO)).
Este compuesto posee ocho lugares en donde el ion se une, que corresponden a los átomos de oxígeno de los grupos C=O y N-OH, quedando el Bk4+ unido firmemente al ligando, permaneciendo estable.
El Bk4+ puede coprecipitar con cerio (Ce4+) o zirconio (Zr4+) en forma de fosfato o yodato. También puede ser extraído en soluciones de hexano de bis(2-etilhexil)hidrogenofosfato u otro agente acomplejante similar.
El primer compuesto de berkelio que se produjo en cantidades visibles fue el cloruro (BkCl3), del cual se obtuvieron 0,000000003 gramos en 1962. Desde entonces varios compuestos del berkelio que se han podido preparar y estudiar.
Se pueden mencionar por ejemplo el fosfato (BkPO4), el oxicloruro (BkOCl), los fluoruros (BkF3 y BkF4), el dióxido (BkO2), el trióxido (Bk2O3), los yodatos (Bk(IO3)3 y Bk(IO3)4), el clorohidrato [BkCl2(H2O)6]Cl, el oxalato, compuestos organometálicos y compuestos de coordinación, entre otros.
En 2018 un grupo de investigadores de varios países logró producir un complejo de nitrato con berkelio pentavalente (Bk5+) cuya fórmula es BkO2(NO3)2–, mediante la eliminación de dos moléculas de NO2 del ion Bk(NO3)4–, (Bk3+).
Cálculos computacionales de energía confirmaron que el estado de oxidación +5 es el que posee mayor estabilidad en este complejo de nitrato de berkenilo, siendo por tanto el más probable.
Del berkelio se han podido sintetizar 14 isótopos con masas atómicas desde 238 hasta 251. Todos son radiactivos.
El más estable es el berkelio-247, cuya vida media es de 1380 años. Cada átomo de este isótopo cuando se desintegra emite una partícula alfa y forma un átomo de americio-243.
El Bk-249 tiene una vida media de 330 días, sufre decaimiento beta y se convierte en californio-249.
Dado que solo se han podido obtener muy pequeñas cantidades de este elemento, tiene uso únicamente en la investigación científica básica.
El isótopo Bk-249 tiene una vida media relativamente larga y es posible obtenerlo en cantidades de microgramos, por lo que se utiliza para sintetizar elementos más pesados mediante el bombardeo de sus átomos con partículas cargadas.

Las investigaciones realizadas con el Bk permiten realizar extrapolaciones más precisas acerca de las propiedades y comportamiento de otros elementos que le siguen en la serie de los actínidos, pues los elementos más pesados son más difíciles de obtener, poseen vidas medias muy cortas y son mucho más radiactivos.
El berkelio es un elemento radiactivo. La liberación de radiactividad en el ambiente puede alcanzar todas las especies de animales y plantas causando daño en ellas. El deterioro puede acumularse en las sucesivas generaciones.

- U.S. National Library of Medicine. (2019). Berkelium – Bk (Element). Recuperado de pubchem.ncbi.nlm.nih.gov.
- White, F.D. et al. (2019). Contemporary Chemistry of Berkelium and Californium. Chemistry 2019 Aug 6; 25(44): 10251-10261. Recuperado de pubmed.ncbi.nlm.nih.gov.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Kelley, M.P. et al. (2018). Bond Covalency and Oxidation State of Actinide Ions Complexed with Therapeutic Chelating Agent 3,4,3-LI(1,2-HOPO). Inorg. Chem. 2018 May 7; 57(9): 5352-5363. Recuperado de pubmed.ncbi.nlm.nih.gov.
- Kovács, A. et al. (2018). Pentavalent Curium, Berkelium, and Californium in Nitrate Complexes: Extending Actinide Chemistry and Oxidation States. Chem. 2018 Aug 6; 57(15): 9453-9467. Recuperado de pubmed.ncbi.nlm.nih.gov.
- Orlova, A.I. (2007). Chemistry and structural chemistry of anhydrous tri- and tetravalent actinide orthophosphates. In Structural Chemistry of Inorganic Actinide Compounds. Recuperado de sciencedirect.com.
- Choppin, G. et al. (2013). The Actinide and Transactinide Elements. In Radiochemistry and Nuclear Chemistry (Fourth Edition). Recuperado de sciencedirect.com.
- Peterson, J.R. and Hobart, D.E. (1984). The Chemistry of Berkelium. Advances in Inorganic Chemistry, Volume 28, 1984, pages 29-72. Recuperado de sciencedirect.com.
- Royal Society of Chemistry. (2020). Berkelium. Recuperado de rsc.org.
