Proteólisis: tipos y funciones
La proteólisis o degradación de proteínas es un proceso por el cual las proteínas de una célula pueden ser degradadas de manera completa (hasta sus aminoácidos constituyentes) o parcialmente (produciendo péptidos). Es decir, consiste en la hidrólisis de uno o más de los enlaces peptídicos que mantienen unidos a sus aminoácidos.
Este proceso puede ocurrir gracias a la participación de otras proteínas con actividad enzimática, en cuyos sitios activos se produce la hidrólisis de los enlaces. También puede ocurrir por “métodos” no enzimáticos, como por acción del calor o de sustancias con pH extremos (muy ácidas o muy básicas).

La degradación de proteínas se da tanto en bacterias como en animales y en plantas, pero es especialmente común en los animales, sobre todo a nivel del aparato digestivo, pues de ello depende la digestión y absorción intestinal de las proteínas ingeridas con la dieta.
Además, la proteólisis es de suma importancia para el mantenimiento funcional y la regulación de múltiples procesos celulares y tiene que ver también con la eliminación de aquellas proteínas que presentan errores de traducción, de plegamiento, de empaquetamiento, de importación, de funcionamiento, etc.
Es importante destacar que se trata de un proceso irreversible, sumamente efectivo y que también funciona en la “regulación de los reguladores”, pues no solo elimina aquellas proteínas que tienen actividades biológicas “directas”, sino también a aquellas que regulan a otras proteínas o la expresión de los genes correspondientes.
Índice del artículo
Las proteínas internas de una célula pueden ser degradadas aleatoria o selectivamente o, lo que es igual, de manera controlada o no. A su vez, como se ha comentado previamente, este proceso puede ocurrir por medio de enzimas especiales o debido a condiciones ambientales definidas como pH ácidos y/o alcalinos.
Es importante mencionar que cualquier proteína correctamente traducida, plegada o empaquetada esconde una o más secuencias señales de degradación que son “crípticas” y que pueden exponerse cuando la proteína es perturbada estructuralmente por temperatura, pH, etc.
La ubiquitinación (sistema ubiquitina-proteosoma) es un sistema por el cual las proteínas pueden ser selectivamente hidrolizadas luego de ser marcadas específicamente para su degradación, proceso que puede ocurrir tanto en el citosol como en el núcleo celular.
Este sistema tiene la capacidad de reconocer y destruir proteínas marcadas en el núcleo y en el citosol, así como de degradar las proteínas que no se pliegan correctamente durante su translocación desde el citosol hacia el retículo endoplásmico.
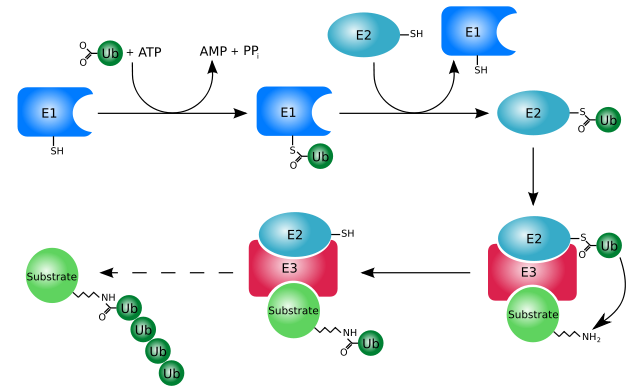
Funciona principalmente mediante la adición o conjugación de las proteínas “blanco” a una pequeña proteína o péptido de 76 residuos aminoacídicos, más conocida como ubiquitina. Aquellas proteínas “marcadas” por ubiquitinación son degradadas en pequeños fragmentos por el proteosoma 26S, una proteasa de varias subunidades.
La autofagia también es considerada por algunos autores como una forma de proteólisis, con la distinción de que esta ocurre dentro de un compartimento membranoso cerrado que es dirigido hacia los lisosomas (en las células animales), donde las proteínas contenidas en su interior son degradadas por las proteasas lisosomales.
La temperatura, el pH, e incluso la concentración de sales de un medio puede provocar la hidrólisis de los enlaces peptídicos que mantienen unidos los aminoácidos de distintos tipos de proteínas, lo que ocurre por desestabilización e interrupción de los enlaces.
La proteólisis tiene muchas funciones en los organismos vivos. Particularmente, tiene que ver con el recambio de proteínas, por el cual algunas moléculas de proteínas específicas que fueron traducidas a partir de uno o más ribosomas, eventualmente son degradadas a diferentes velocidades.
Las proteínas tienen una vida media que varía desde pocos segundos hasta algunos meses y los productos de su degradación, sea regulada o no, mediada por enzimas o no, generalmente son reutilizados para la síntesis de nuevas proteínas, que probablemente cumplen funciones diferentes.
Esto es lo que sucede con las proteínas que son consumidas con los alimentos, que son degradadas en el tracto gastrointestinal por proteasas entre las que se incluyen la tripsina y la pepsina; así como con algunas proteínas celulares cuando las células carecen de suficientes alimentos para sobrevivir.
Los sistemas proteolíticos intracelulares detectan y eliminan las proteínas “anormales” que son potencialmente tóxicas para las células, pues pueden interactuar con ligandos “fisiológicamente inapropiados”, además de producir agregados que provocan impedimentos mecánicos y físicos para los procesos celulares normales.
La acumulación de proteínas anormales en el interior celular, bien sea por defectos en el sistema proteolítico interno o por otras razones, es lo que muchos científicos consideran como una de las causas principales del envejecimiento en los seres vivos multicelulares.
La proteólisis parcial de muchas proteínas provenientes de fuentes exógenas o foráneas como microorganismos invasores, por ejemplo, es un proceso fundamental para el sistema de respuesta inmune, pues los linfocitos T reconocen los fragmentos cortos, producto de la proteólisis (péptidos) que les son presentados en asociación con un conjunto de proteínas de superficie.
Dichos péptidos pueden provenir del sistema de ubiquitinación, de procesos autofágicos o de eventos de proteólisis no controlada.
Otra función de la proteólisis limitada o parcial es la modificación de proteínas recién formadas, lo que funciona como una “preparación” para sus funciones intra- o extracelulares. Esto es cierto, por ejemplo, para ciertas hormonas y para las proteínas implicadas en distintos procesos metabólicos.
La muerte celular programada (apoptosis) también depende, en gran medida, de la proteólisis “sitio-específica”, limitada o parcial de las proteínas intracelulares, lo que es mediado por una cascada de proteasas específicas denominadas caspasas.
Los sistemas de regulación extracelulares también dependen de la proteólisis sitio-específica y el ejemplo más resaltante es el de la coagulación sanguínea.
La proteólisis general o completa también cumple funciones primordiales para la degradación selectiva de aquellas proteínas cuya concentración debe ser cuidadosamente controlada dependiendo del estado fisiológico, metabólico o del desarrollo de las células.
Las plantas también se valen de los procesos proteolíticos para el control de muchos de sus aspectos fisiológicos y del desarrollo. Funciona, por ejemplo, en el mantenimiento de las condiciones intracelulares y en los mecanismos de respuesta a condiciones estresantes como la sequía, la salinidad, la temperatura, entre otras.
Así como en los animales, la proteólisis en los vegetales colabora en la activación y maduración de zimógenos (proteínas inactivas), controla el metabolismo, la homeostasis, los procesos de muerte celular programada, el desarrollo de tejidos y órganos, etc. En estos organismos la vía de proteólisis por ubiquitinación es una de las más importantes.
- Alberts, B., Bray, D., Hopkin, K., Johnson, A. D., Lewis, J., Raff, M., … & Walter, P. (2013). Essential cell biology. Garland Science.
- Maurizi, M. R. (1992). Proteases and protein degradation in Escherichia coli. Experientia, 48(2), 178-201.
- Varshavsky, A. (2005). Regulated protein degradation. Trends in biochemical sciences, 30(6), 283-286.
- Vierstra, R. D. (1996). Proteolysis in plants: mechanisms and functions. In Post-Transcriptional Control of Gene Expression in Plants (pp. 275-302). Springer, Dordrecht.
- Wolf, D. H., & Menssen, R. (2018). Mechanisms of cell regulation–proteolysis, the big surprise. FEBS letters, 592(15), 2515-2524.
