Capa de valencia: qué es, definición, características, ejemplos
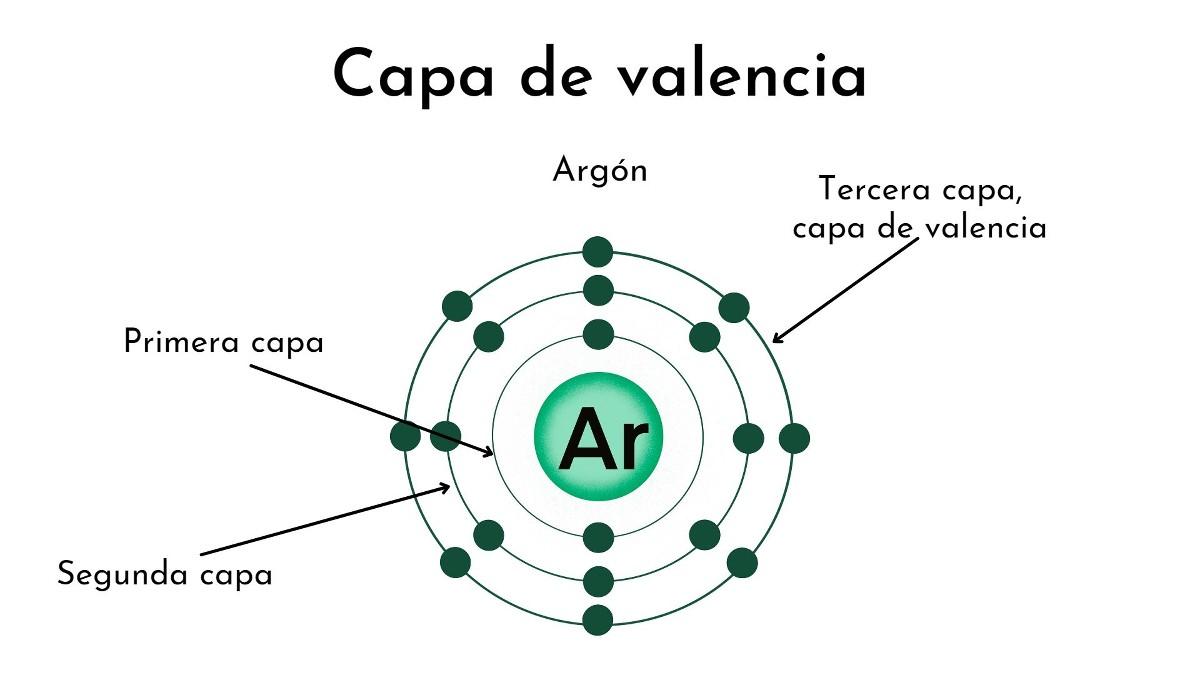
¿Qué es la capa de valencia?
La capa de valencia es aquella cuyos electrones son los responsables de las propiedades químicas de un elemento. Los electrones en esta capa interactúan con los de un átomo vecino, para formar así enlaces covalentes (A-B); y si emigran de un átomo a otro más electronegativo, enlaces iónicos (A+B–).
Esta capa viene definida por el número cuántico principal n, el cual a su vez indica el período donde se encuentra el elemento en la tabla periódica. Mientras que el ordenamiento por grupos depende del número de electrones orbitando en la capa de valencia.
De manera que para un n igual a 2, puede ocupar ocho electrones: ocho grupos (1-8).
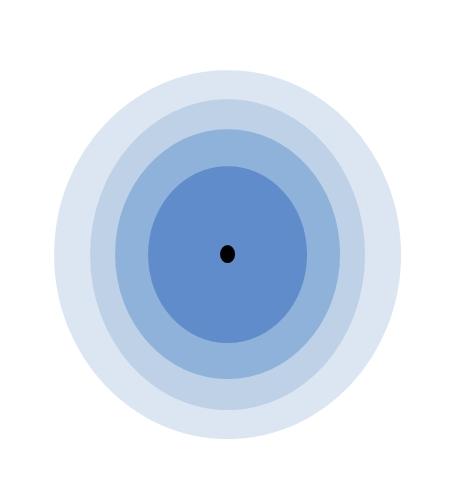
En la imagen superior y en la de portada se ilustra el significado de la capa de valencia. El punto negro en el centro del átomo es el núcleo, mientras que los restantes círculos concéntricos son las capas electrónicas definidas por n.
¿Cuántas capas tiene este átomo? Cada una de ellas posee un color propio, y al haber cuatro, entonces el átomo tiene cuatro capas (n=4).
Nótese también que el color va degradándose conforme aumenta la distancia de la capa al núcleo. La capa de valencia es la que se encuentra más alejada del núcleo: la del color más claro.
¿En qué consiste la capa de valencia?
De acuerdo con la imagen, la capa de valencia no es más que los últimos orbitales de un átomo ocupados por electrones. En la capa azul claro, para n=4 hay una serie de orbitales 4s, 4p, 4d y 4f; es decir, dentro hay otras subcapas con diferentes capacidades electrónicas.
Un átomo necesita de electrones para poder llenar todos los orbitales 4n. Este proceso puede observarse en las configuraciones electrónicas de los elementos a lo largo de un período.
Por ejemplo, el potasio tiene configuración electrónica [Ar]4s1, mientras que el calcio, a su derecha, [Ar]4s2.
De acuerdo con estas configuraciones, ¿cuál es la capa de valencia? El término [Ar] alude a la configuración electrónica del gas noble argón 1s22s22p63s23p6. Esta representa la capa interna o cerrada (lo que también se conoce como kernel).
Dado que el orbital 4s es el de mayor energía, y en el que entran los nuevos electrones, este representa la capa de valencia tanto para el K como para el Ca. Si se compararan los átomos de K y Ca con el de la imagen, [Ar] sería todas las capas internas de color azul; y 4s la capa de azul claro, la externa.
Características de la capa de valencia
De lo dicho anteriormente puede resumirse algunas características de la capa de valencia para todos los átomos:
-Su nivel energético es más alto; lo que es igual, está más retirada del núcleo y posee la menor densidad electrónica (comparada con otras capas).
-Está incompleta. Por lo tanto, continuará llenándose de electrones a medida que se recorre un período de izquierda a derecha en la tabla periódica.
-Interviene en la formación de enlaces covalentes o iónicos.
Para el caso de los metales potasio y calcio, se oxidan para transformarse en cationes. El K+ tiene configuración electrónica [Ar], debido a que pierde su único electrón externo 4s1. Y por el lado del Ca2+, su configuración también es [Ar]; porque en lugar de perder un electrón, pierde dos (4s2).
Pero, ¿cuál es la diferencia entre el K+ y el Ca2+, si ambos pierden los electrones de su capa de valencia y tienen configuración electrónica [Ar]? La diferencia está en sus radios iónicos.
Ca2+ es más pequeño que K+ debido a que el átomo de calcio cuenta con un protón adicional que atrae con mayor fuerza los electrones externos (capas cerradas o de valencia).
La capa de valencia 4s no ha desaparecido: solo está vacía para estos iones.
Ejemplos de capa de valencia
El concepto de capa de valencia puede hallarse directa o indirectamente en muchos aspectos de la química.
Debido a que sus electrones son los que participan en la formación de enlaces, cualquier tema que los aborde (TEV, RPECV, mecanismos de reacción, etc.) deberá aludir a dicha capa.
Esto se debe a que, más importante que la capa de valencia, son sus electrones, llamados electrones de valencia. Al representarse en la construcción progresiva de las configuraciones electrónicas, estos definen la estructura electrónica del átomo, y, por tanto, sus propiedades químicas.
A partir de esta información de un átomo A y otro B, pueden bosquejarse las estructuras de sus compuestos a través de las estructuras de Lewis. Asimismo, se pueden determinar las estructuras electrónicas y moleculares de una gama de compuestos gracias al número de electrones de valencia.
Los ejemplos posibles y más simples de capas de valencias se hallan en la tabla periódica; específicamente, en las configuraciones electrónicas.
Ejemplo 1
Es posible identificar un elemento y su ubicación en la tabla periódica únicamente con la configuración electrónica. Así, si un elemento X tiene configuración [Kr]5s25p1, ¿de cuál se trata y a qué período y grupo pertenece?
Dado que n=5, X se encuentra en el quinto período. Además, posee tres electrones de valencia: dos en el orbital 5s2 y uno en el 5p1. La capa interna [Kr] no aporta más información.
Como X posee tres electrones, y sus orbitales 5p están incompletos, está en el bloque p; más aún, en el grupo IIIA (sistema románico) o 13 (sistema de numeración actual y aprobado por la IUPAC). X se trata entonces del elemento indio, In.
Ejemplo 2
¿Cuál es el elemento X con configuración electrónica [Kr]4d105s1? Nótese que al igual que el In, pertenece al período 5, ya que el orbital 5s1 es el de mayor energía. Sin embargo, la capa de valencia también incluye a los orbitales 4d, puesto que están incompletos.
Las capas de valencias pueden entonces designarse como nsnp, para un elemento del bloque p o s; o (n-1)dns, para un elemento del bloque d. De modo que el elemento misterioso X pertenece al bloque d porque su configuración electrónica es del tipo (n-1)dns (4d105s1).
¿A cuál grupo pertenece? Sumando los diez electrones del orbital 4d10, y uno del 5s1, X tiene once electrones de valencia. Por lo tanto, debe ubicarse en el grupo IB u 11. Desplazándose entonces por el período 5 de la tabla periódica hasta el grupo 11 se llega al elemento plata, Ag.
Referencias
- Shiver & Atkins. (2008). Química Inorgánica (cuarta edición, pág. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Química (8va ed.). CENGAGE Learning, p. 287.
- NDT Resource Center (s.f.). The Valence Shell. Tomado de: nde-ed.org
- Clackamas Community College (2002). Valence Electrons. Recuperado de: dl.clackamas.edu
- Chemistry LibreTexts (s.f.). Valence and Core Electrons. Recuperado de: chem.libretexts.org
